Ⅰ.25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | NH3⋅H2O | HClO | H2SO3 |
| 电离平衡常数 | 1.77×10-5 | K1═4.3×10-7K2═5.6×10-11 | 1.770×10-5 | 4.0×10-8 | K1═1.3×10-2K2═6.3×10-8 |
H2SO3+OH-=+H2O
HSO
-
3
H2SO3+OH-=+H2O
。溶液显 HSO
-
3
酸性
酸性
(填“酸性”、“碱性”或“中性”)。(2)写出向Na2SO3溶液中通入少量CO2的离子方程式
SO
2
-
3
HSO
-
3
HCO
-
3
SO
2
-
3
HSO
-
3
HCO
-
3
(3)常温下0.1mol/L的(NH4)2CO3溶液,该溶液中各微粒浓度之间关系式错误的是
AC
AC
。A.c(
NH
+
4
HCO
-
3
CO
2
-
3
B.c(
NH
+
4
HCO
-
3
CO
2
-
3
C.c(H+)+c(
HCO
-
3
D.c(
NH
+
4
CO
2
-
3
HCO
-
3
Ⅱ.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol⋅L-1HA溶液中逐滴加入0.1000mol⋅L-1的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
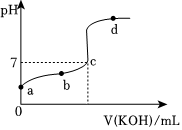
(4)a点溶液中H2O电离出的c(H+)为
2.5×10-11
2.5×10-11
mol/L。(5)a、b、c、d四点中水的电离程度最大的是
c
c
点。【答案】H2SO3+OH-=+H2O;酸性;+CO2+H2O=+;AC;2.5×10-11;c
HSO
-
3
SO
2
-
3
HSO
-
3
HCO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/13 16:0:4组卷:7引用:2难度:0.5


