硫铁矿(含FeS2)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
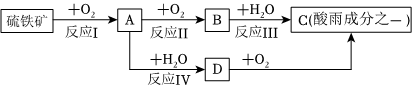
回答下列问题:
(1)硫铁矿(FeS2)中硫元素化合价为 -1-1。
(2)为了确定A中S元素的化合价,将其通入酸性高锰酸钾溶液中,发现溶液褪色,请写出该过程的离子方程式 5SO2+2MnO-4+2H2O=5SO24-+2Mn2++4H+5SO2+2MnO-4+2H2O=5SO24-+2Mn2++4H+。
(3)已知反应Ⅲ是放热反应,该反应也是工业制硫酸的主要步骤之一,但在实际工业生产中常用98.3%的浓硫酸代替水来吸收B气体,其目的是 防止形成酸雾,影响吸收的效率防止形成酸雾,影响吸收的效率。
(4)利用氧化亚铁硫杆菌(T•f)对硫铁矿进行催化脱硫的过程如图所示:
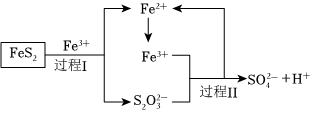
已知催化脱硫过程的总反应为:
FeS2+14Fe3++8H2O═2SO2-4+15Fe2++16H+
①则过程Ⅱ反应的离子方程式为 8Fe3++5H2O+S2O2-3=8Fe2++2SO2-4+10H+8Fe3++5H2O+S2O2-3=8Fe2++2SO2-4+10H+。
②脱硫过程中产生的S2O2-3在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是 S2O2-3+2H+=S↓+SO2↑+H2OS2O2-3+2H+=S↓+SO2↑+H2O(用离子方程式表示)。
③该催化过程中,要控制反应温度不能过高,原因是 温度太高,催化剂失去活性温度太高,催化剂失去活性。
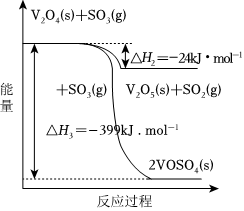
(5)接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+12O2(g)钒催化剂SO3(g)ΔH=-98kJ•mol-1。钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:2V2O5(s)+2SO2(g)⇌2VOSO4(s)+V2O4(s) ΔH=-351kJ•mol-12V2O5(s)+2SO2(g)⇌2VOSO4(s)+V2O4(s) ΔH=-351kJ•mol-1。
M
n
O
-
4
SO
2
4
M
n
O
-
4
SO
2
4
SO
2
-
4
O
2
-
3
SO
2
-
4
O
2
-
3
SO
2
-
4
O
2
-
3
O
2
-
3
O
2
-
3
1
2
钒催化剂
【答案】-1;5SO2+2+2H2O=5-+2Mn2++4H+;防止形成酸雾,影响吸收的效率;8Fe3++5H2O+S2=8Fe2++2+10H+;S2+2H+=S↓+SO2↑+H2O;温度太高,催化剂失去活性;2V2O5(s)+2SO2(g)⇌2VOSO4(s)+V2O4(s) ΔH=-351kJ•mol-1
M
n
O
-
4
SO
2
4
O
2
-
3
SO
2
-
4
O
2
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/12 2:0:2组卷:35引用:1难度:0.5
相似题
-
1.关于工业上用接触法制硫酸的说法不正确的是( )
发布:2024/12/30 5:30:2组卷:28引用:3难度:0.7 -
2.硫酸在化工生产国民经济发展中占有极其重要的地位,如图是工业接触法制硫酸的简单流程图。
试回答下列有关问题: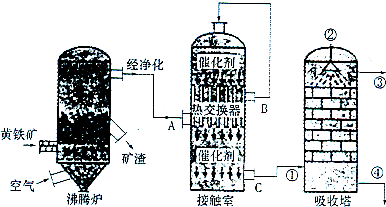
(1)写出工业上用FeS2制取SO2的化学方程式;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、;
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在,在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是;
(4)硫酸工厂形成的“三废”对环境有较大的影响,处理硫酸工厂尾气的化学方程式是;
(5)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫;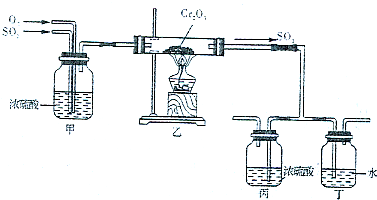
①若丁装置在反应过程中出现气泡,不久就出现了自雾,而丙装置一直没有明显变化,丁装置产生白雾的原因是,此现象对工业上制硫酸带来的不良后果是;
②上图中的乙装置和丙装置分别与工业制取硫酸的某个装置相对应,其中乙装置对应的是接触室; 丙装置对应的是。发布:2024/12/30 6:0:2组卷:13引用:2难度:0.5 -
3.有关接触法制硫酸的叙述.其中不正确的是( )
发布:2024/12/30 6:0:2组卷:26引用:3难度:0.7


