铁盐溶液浓度较低时肉眼几乎观察不到颜色,某研究小组利用配合物的特征颜色检测久置硫酸亚铁补铁片中铁元素价态。
Ⅰ.补铁片中Fe3+的检验
资料i:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+
实验过程如图:
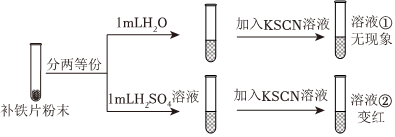
(1)分析上述溶液,除H2O外还能与Fe3+配位的微粒有 SCN-、OH-SCN-、OH-。
(2)已知H2O的配位对Fe3+的检验无影响。结合化学用语,从平衡移动的角度解释溶液①无现象,溶液②变红的原因:溶液①中,OH-与Fe3+配位能力强,使Fe3+无法与SCN-配位,因此无现象,溶液②中H+浓度增大,使[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+逆向移动,OH-与Fe3+配位能力减弱,Fe3++3SCN-⇌Fe(SCN)3,因此溶液②变红溶液①中,OH-与Fe3+配位能力强,使Fe3+无法与SCN-配位,因此无现象,溶液②中H+浓度增大,使[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+逆向移动,OH-与Fe3+配位能力减弱,Fe3++3SCN-⇌Fe(SCN)3,因此溶液②变红。
结论:用KSCN溶液检验Fe3+须在酸性条件下进行。进一步实验表明,KSCN溶液检验Fe3+时pH需小于3。
Ⅱ.邻二氮菲检验Fe2+的酸碱性条件
资料ii:邻二氮菲的结构简式为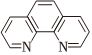 ,可与 Fe2+形成稳定的橙红色邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。
,可与 Fe2+形成稳定的橙红色邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。
实验过程如图:
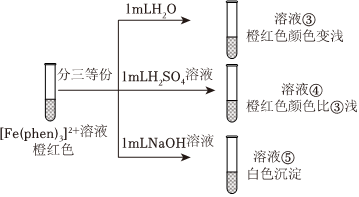
(3)结合邻二氮菲的结构,分析说明溶液④颜色比③浅的原因:H+浓度较大,邻二氮菲中N原子有孤电子对,H+中有空轨道,因此邻二氮菲与H+形成配位键,而不与Fe2+配位,因此溶液④颜色比③中浅H+浓度较大,邻二氮菲中N原子有孤电子对,H+中有空轨道,因此邻二氮菲与H+形成配位键,而不与Fe2+配位,因此溶液④颜色比③中浅。
结论:邻二氮菲与Fe2+形成配合物的反应受pH的影响。进一步实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9。
(4)由以上实验也可得知,中心离子结合配体的能力与 中心离子和配体的浓度、种类中心离子和配体的浓度、种类有关。
【考点】性质实验方案的设计.
【答案】SCN-、OH-;溶液①中,OH-与Fe3+配位能力强,使Fe3+无法与SCN-配位,因此无现象,溶液②中H+浓度增大,使[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+逆向移动,OH-与Fe3+配位能力减弱,Fe3++3SCN-⇌Fe(SCN)3,因此溶液②变红;H+浓度较大,邻二氮菲中N原子有孤电子对,H+中有空轨道,因此邻二氮菲与H+形成配位键,而不与Fe2+配位,因此溶液④颜色比③中浅;中心离子和配体的浓度、种类
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/3 0:0:8组卷:109引用:2难度:0.1
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
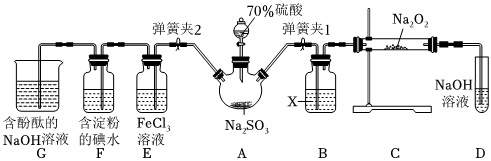
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
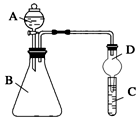 2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
3.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色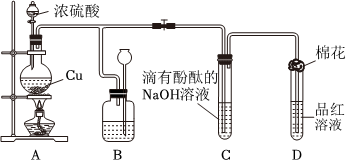 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7


