如图为实验室制取氨气,二氧化硫及有关性质实验的组合装置。

(1)如果A、E是气体制取装置,则按照题目要求,A中制取气体的化学反应方程式为 2NH4Cl+Ca(OH)2 △ 2NH3↑+CaCl2+2H2O2NH4Cl+Ca(OH)2 △ 2NH3↑+CaCl2+2H2O。
(2)在此实验中B应加入 碱石灰碱石灰(写名称),B仪器名称 球形干燥管球形干燥管。
(3)先加热A装置,使产生气体通入烧瓶F中,此时弹簧夹a、b打开、c关闭。当F中充满A中气体后,A停止制气,关闭a,打开弹簧夹c,使E中气体通入F中:
①检验F中已充满大量A中气体的方法:将湿润的红色石蕊试纸靠近b管口,观察试纸是否变蓝,若变蓝,则已收集满,若无明显现象,则未收集满将湿润的红色石蕊试纸靠近b管口,观察试纸是否变蓝,若变蓝,则已收集满,若无明显现象,则未收集满;
②D的作用是干燥气体,D中盛的是 浓硫酸浓硫酸(写名称)。
(4)A、E中产生的气体都是有污染性的,吸收A尾气的试剂是 水(稀硫酸)水(稀硫酸),吸收E尾气的离子方程式为 SO2+2OH-=SO2-3+H2OSO2+2OH-=SO2-3+H2O。
(5)生石灰与水反应生成Ca(OH)2并放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是 cc(填“a”、“b”或“c”)。

(6)为使生成的氨被硫酸吸收时不发生倒吸,可以选用下列装置中的 ACAC(填“A”、“B”或“C”)。

(7)该小组又设计如图所示的实验装置(固定装置略),进行SO2性质的研究:

①可用来验证SO2具有漂白性的现象是:B中品红溶液褪色B中品红溶液褪色。
②从元素化合价的角度分析,SO2的性质:
a、当通入SO2一段时间后,可观察C中溶液褪色,说明SO2具有 还原还原性。
b、如要验证SO2还具有另一方面的性质,D装置中的药品应为 CC。
A.FeCl3溶液
B.氯水
C.氢硫酸
D.浓硝酸
△
△
S
O
2
+
2
O
H
-
=
S
O
2
-
3
+
H
2
O
S
O
2
+
2
O
H
-
=
S
O
2
-
3
+
H
2
O
【答案】2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;碱石灰;球形干燥管;将湿润的红色石蕊试纸靠近b管口,观察试纸是否变蓝,若变蓝,则已收集满,若无明显现象,则未收集满;浓硫酸;水(稀硫酸);;c;AC;B中品红溶液褪色;还原;C
△
S
O
2
+
2
O
H
-
=
S
O
2
-
3
+
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/28 8:0:9组卷:33引用:1难度:0.7
相似题
-
1.甲、乙、丙三位同学分别用图1所示实验装置制取氨气.请你根据实验探究的过程,回答下列有关问题.
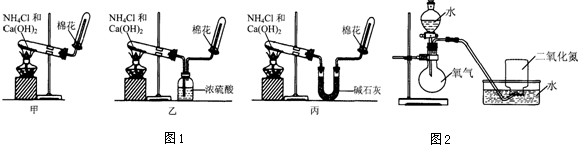
(1)三位同学制取氨气的化学方程式是.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是(填图1中“甲”、“乙”或“丙”).
(3)为确定试管内是否已收集满氨气,应将置于收集气体的试管口处,若观察到,则说明氨气已收集满.
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的同学是(填图1中“甲”、“乙”或“丙”).
(5)氨气是一种重要的化工产品,氨气经一系列反应可制得硝酸,其中关键步骤之一是将二氧化氮溶于水生成硝酸.为使二氧化氮尽可能全部被水吸收,且残留的气体尽可能少,某同学设计了如图2所示的实验装置,进行了如下实验探究过程.请回答有关问题.实验过程 实验现象 步骤一 将收集满NO2的集气瓶倒立在水槽中. 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的 .步骤二 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. 集气瓶中气体颜色的变化情况是 ;集气瓶中液面继续上升.步骤三 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成 色.现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. 计算 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为 .发布:2024/12/30 5:0:1组卷:64引用:3难度:0.3 -
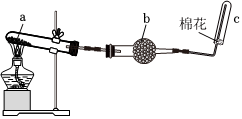 2.某化学研究小组的同学在实验室中利用如图装置制取并收集少量干燥NH3。下列叙述正确的是( )发布:2024/12/30 7:30:1组卷:130引用:2难度:0.8
2.某化学研究小组的同学在实验室中利用如图装置制取并收集少量干燥NH3。下列叙述正确的是( )发布:2024/12/30 7:30:1组卷:130引用:2难度:0.8 -
3.实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
发布:2024/12/30 5:30:2组卷:36引用:6难度:0.9


