Ⅰ.CH3COOH是一种常见的酸,Ka(CH3COOH)=1.75×10-5,可以形成多种醋酸盐。回答下列问题:
(1)在室温下,0.175mol•L-1醋酸钠溶液的pH约为 99。
(2)在室温下,若下列溶液的物质的量浓度相同:①CH3COONH4②NH4HSO4③NH4Cl④NH3•H2O,则c(NH+4)从大到小的顺序为 ②③①④②③①④。
(3)在室温下,等物质的量浓度的CH3COOH与NaOH以体积比2:1混合,混合后溶液的pH=5,求c(Na+)-c(CH3COOH)=(10-5-10-9) mol/L(10-5-10-9) mol/L(写出计算结果的表达式)。
(4)冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加,c(H+)的变化曲线 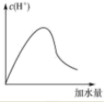
 。
。

Ⅱ.已知次磷酸(H3PO2)是一种一元弱酸;电离平衡常数Ka(H3PO2)=5.9×10-2。
(5)写出次磷酸与足量NaOH反应的离子方程式 H3PO2+OH-=H2PO-2+H2OH3PO2+OH-=H2PO-2+H2O。
(6)下列说法正确的是 BDBD(填字母)。
A.导电能力CH3COOH<H3PO2
B.H3PO2溶液中加入小苏打,可以看到气泡
C.NaH2PO2溶液中的离子种类比CH3COONa溶液中的离子种类多
D.常温下,0.1mol•L-1NaH2PO2溶液的pH比0.1mol•L-1CH3COONa溶液的pH小
NH
+
4


PO
-
2
PO
-
2
【答案】9;②③①④;(10-5-10-9) mol/L; ;H3PO2+OH-=H2+H2O;BD
;H3PO2+OH-=H2+H2O;BD
 ;H3PO2+OH-=H2
;H3PO2+OH-=H2PO
-
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/13 12:0:2组卷:5引用:1难度:0.6


