氨是化肥工业和基本有机化工的主要原料。合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)ΔH<0,回答下列问题:
(1)写出一种提高NH3产率的方法 及时分离出氨气(合理即可)及时分离出氨气(合理即可)。
(2)恒温恒容下,向密闭容器中充入一定量的N2和H2则下列条件中一定能判断该反应达到平衡状态的是 cdcd。(填字母代号)
a.N2H2和NH3的物质的量浓度之比为1:3:2
b.6amolN-H键断裂的同时生成amolN≡N键
c.容器中气体的平均相对分子质量不变
d.NH3的生成速率与H2的生成速率之比为2:3
(3)某合成氨速率方程为v=kcα(N2)cβ(H2)cγ(NH3),根据表中数据,α=11;γ=-1-1。
| 实验 | c ( N 2 ) mol ⋅ L - 1 |
c ( H 2 ) mol ⋅ L - 1 |
c ( N H 3 ) mol ⋅ L - 1 |
mol•L-1•s-1 |
| 1 | 0.1 | 0.3 | 0.2 | a |
| 2 | 0.2 | 0.3 | 0.2 | 2a |
| 3 | 0.1 | 0.3 | 0.02 | 10a |
| 4 | 0.1 | 0.6 | 0.2 | 2.828a |
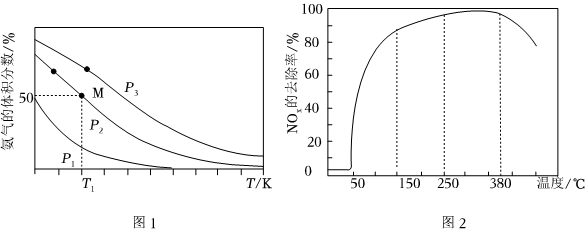
①P1、P2、P3由大到小的顺序是
P3>P2>P1
P3>P2>P1
。②若P2=2MPa,则T1温度下,M点对应的H2的平衡转化率为
66.7
66.7
%(保留3位有效数字),压强平衡常数Kp=256
27
256
27
(5)氮氧化物是空气的污染物之一,在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中,反应相同时间,NOx的去除率随反应温度的变化曲线如图2所示。解释在50~150℃范围内随温度升高,NOx的去除率迅速上升的主要原因是
催化剂M的活性随温度升高而增大,使反应去除速率迅速增大
催化剂M的活性随温度升高而增大,使反应去除速率迅速增大
。【答案】及时分离出氨气(合理即可);cd;1;-1;P3>P2>P1;66.7;;催化剂M的活性随温度升高而增大,使反应去除速率迅速增大
256
27
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/13 18:0:1组卷:14引用:1难度:0.5
相似题
-
1.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)⇌C(g)+D(g)已达到平衡状态( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.发布:2024/12/30 19:30:2组卷:40引用:3难度:0.7 -
2.在一定温度下的定容容器中,反应:A(s)+2B(g)⇌C(g)+D(g)。下列不能表明反应达到平衡状态的是( )
发布:2024/12/30 19:0:1组卷:110引用:4难度:0.8 -
3.二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2O2):
2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是
A.CO和H2的物质的量浓度比是1:2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)═CH3OH(g)△H1=-100.46kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2
CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-38.7kJ/mol
则△H2=。
(3)复合催化剂的制备方法之一是Na2CO3共沉淀法:制备1mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1mol/L的Na2CO3水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。
请写出上述过程中硝酸铝与Na2 CO3水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的(填正、负)极,通DME的电极反应为。发布:2025/1/3 8:0:1组卷:18引用:1难度:0.5


