元素周期律是对元素性质的规律性总结,元素周期表是这种规律的呈现形式。利用元素周期律可以推测一些未知元素可能的性质。根据你所学的周期律,回答下列问题: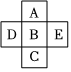
(1)元素周期表有 77个周期,77个主族。
A.6,7
B.7,7
C.7,18
D.7,14
(2)22Ti被誉为21世纪明星金属,其最外层电子数为 BB。
A.1个
B.2个
C.3个
D.5个
(3)元素周期表中,第三电子层有一个未成对电子的元素有 CC种。
A.2
B.3
C.4
D.5
(4)如图所示,元素B与元素A之间的原子序数差值不可能为(同周期原子序数连续的元素视为相邻元素) AA。
A.2
B.8
C.18
D.32
上图中,所有元素最外层电子数之和为20,且D的最外层电子数为A原子序数的一半,回答下列问题:
(5)根据“对角线”相似原则,与D性质相似的元素 BB(填元素符号,下同)。
(6)五种元素中能形成化合物种类最多的为 CC,简述其原因 碳有四个单电子,得失电子能力相近,既可自身成键,也可与其他元素成键,既可成链,也可成环碳有四个单电子,得失电子能力相近,既可自身成键,也可与其他元素成键,既可成链,也可成环。
(7)用一个方程式证明A的非金属性大于B CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3。
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器中得到广泛应用。NF3的键角为102°,其沸点为-129℃,可在铜的催化作用U下由F2和过量NH3反应得到。
(8)根据VSEPR理论计算可知。NF3的理想模型为 正四面体正四面体形,实际为 三角锥三角锥形。
(9)NF3的沸点比NH3的点(-33℃)低得多的主要原因是 NF3分子间存在范德华力,NH3能形成分子间氢键NF3分子间存在范德华力,NH3能形成分子间氢键。
(10)简述NF3的键角为102°而不是109°28′的原因 NF3分子含有1个孤电子对,孤电子对影响键角NF3分子含有1个孤电子对,孤电子对影响键角。
根据下表五种元素第一至第四电离能数据(单位:kJ⋅mol-1),回答下面各题:
| 元素 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
R、U
R、U
。(12)T元素最多可能是
P
P
区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物其中心原子的杂化方式为 sp2
sp2
。【答案】7;7;B;C;A;B;C;碳有四个单电子,得失电子能力相近,既可自身成键,也可与其他元素成键,既可成链,也可成环;CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3;正四面体;三角锥;NF3分子间存在范德华力,NH3能形成分子间氢键;NF3分子含有1个孤电子对,孤电子对影响键角;R、U;P;sp2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/21 8:0:10组卷:43引用:1难度:0.5


