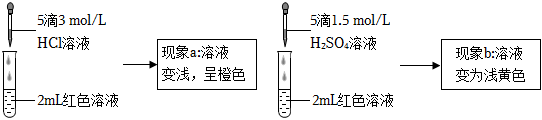
实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3 平衡的影响。将0.005mol/L FeCl3溶液(接近无色)和0.01 mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1)FeCl3水解显酸性的原因是 Fe3++3H2O⇌Fe(OH)3+3H+Fe3++3H2O⇌Fe(OH)3+3H+。(用离子方程式表示)
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中 Fe3+Fe3+浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
Fe3+和Cl-、SO2-4均能发生络合反应:
Fe3++4Cl-⇌[FeCl4]-(黄色);Fe3++2SO2-4⇌[Fe(SO4)2]-(无色)。
实验Ⅰ.探究现象a中溶液颜色变化的原因如表1:
表1:
SO
2
-
4
SO
2
-
4
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/L KCl溶液 | 溶液颜色变浅,呈橙色 |
排除稀释使溶液颜色变化的干扰
排除稀释使溶液颜色变化的干扰
。(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
在Fe3++3SCN-⇌Fe(SCN)3平衡体系中加入盐酸,铁离子、氯离子发生络合反应,使得铁离子浓度减小,平衡逆向进行,Fe(SCN)3离子浓度减小,溶液颜色变浅,呈橙色
在Fe3++3SCN-⇌Fe(SCN)3平衡体系中加入盐酸,铁离子、氯离子发生络合反应,使得铁离子浓度减小,平衡逆向进行,Fe(SCN)3离子浓度减小,溶液颜色变浅,呈橙色
。实验Ⅱ.探究现象b中溶液呈浅黄色的原因如表2
表2:
| 编号 | 操作 | 现象 |
| ③ | 取1 mL 0.0025 mol/L Fe2(SO4)3溶液(无色),加入1mL 0.01 mol/L KSCN溶液,再加入5滴1.5 mol/L H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1 mL 0.005 mol/L FeCl3溶液, 加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液 加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液 |
得到无色溶液 得到无色溶液
|
[FeCl4]-或Fe(SCN)3
[FeCl4]-或Fe(SCN)3
。(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液;得到无色溶液
加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液;得到无色溶液
。【答案】Fe3++3H2O⇌Fe(OH)3+3H+;Fe3+;排除稀释使溶液颜色变化的干扰;在Fe3++3SCN-⇌Fe(SCN)3平衡体系中加入盐酸,铁离子、氯离子发生络合反应,使得铁离子浓度减小,平衡逆向进行,Fe(SCN)3离子浓度减小,溶液颜色变浅,呈橙色;加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液;得到无色溶液;[FeCl4]-或Fe(SCN)3;加入蒸馏水,再加入5滴1.5mol/LH2SO4溶液;得到无色溶液
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/8 8:0:10组卷:121引用:6难度:0.7
相似题
-
1.将5mL 0.005mol/LFeCl3溶液和5mL 0.015mol/LKSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
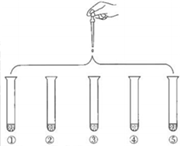
实验①:滴加4滴蒸馏水,振荡 实验②:滴4滴1mol•L-1KCl溶液,振荡 实验③:滴4滴饱和FeCl3溶液,振荡 实验④:滴4滴1mol•L-1KSCN溶液,振荡 实验⑤:滴4滴6mol•L-1NaOH溶液,振荡 发布:2024/12/14 8:0:2组卷:46引用:1难度:0.5 -
2.为探究浓度对化学平衡的影响,某同学进行如下实验,下列说法不正确的是( )
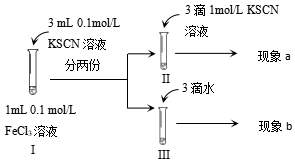 发布:2024/5/27 14:0:0组卷:163引用:5难度:0.5
发布:2024/5/27 14:0:0组卷:163引用:5难度:0.5 -
3.某研究小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)酸性高锰酸钾溶液与草酸反应的现象为实验
序号实验
温度/K有关物质 溶液颜色褪至无色所需时间/min 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol•L-1 V mL c/mol•L-1 V/mL A 298 5 0.02 5 0.2 0 t1 B T1 5 0.02 3 0.2 V1 1 C 318 5 0.02 V2 0.2 2 t2 ,反应的离子方程式为。
(2)通过实验A、B的对比,可探究出反应物浓度的改变对化学反应速率的影响,其中V1=、T1=;通过实验的对比(填实验序号),可探究出温度变化对化学反应速率的影响,其中V2=。
(3)忽略溶液体积的变化,利用实验B中数据计算,0~1min内,用H2C2O4溶液的浓度变化表示的反应速率v(H2C2O4)=mol•L-1•min-1。
(4)已知,上述实验过程中Mn2+对反应有催化作用,请画出n(Mn2+)随时间变化的图象。
(5)若实验室用标准高锰酸钾溶液滴定待测草酸溶液的物质的量浓度,实验数据如表所示。
滴定终点的现象为实验序号 0.1000mol/L高锰酸钾溶液的体积(mL) 待测草酸溶液的体积(mL) ① 21.08 25.00 ② 21.12 25.00 ③ 21.10 25.00 ④ 24.06 25.00 ,待测草酸溶液的浓度为。发布:2024/4/20 14:35:0组卷:104引用:1难度:0.3


