燃煤烟气中主要成分是空气,SO2和NO的含量小于1%。一种用CO(NH2)2(尿素)和H2O2在固体催化剂作用下脱硫、脱硝的流程如图:
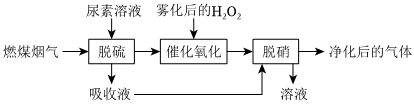
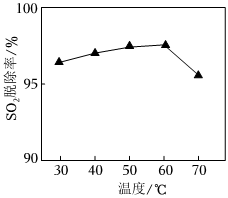
(1)CO(NH2)2可以水解生成(NH4)2CO3,CO(NH2)2、(NH4)2CO3与烟气中的NO不反应。脱硫后所得吸收液中含CO(NH2)2、(NH4)2SO3、(NH4)2SO4。其他条件一定,反应相同时间,测得SO2的脱除率与温度的关系如图所示。30~70℃时,SO2的脱除率随温度升高先增大后减小的原因是 30~60℃时升高温度,CO(NH2)2水解生成(NH4)2CO3的速率加快,溶液中(NH4)2CO3的浓度增大,且升高温度可加快反应速率;60~70℃时SO2在溶液中的溶解量减少,反应速率减慢30~60℃时升高温度,CO(NH2)2水解生成(NH4)2CO3的速率加快,溶液中(NH4)2CO3的浓度增大,且升高温度可加快反应速率;60~70℃时SO2在溶液中的溶解量减少,反应速率减慢。
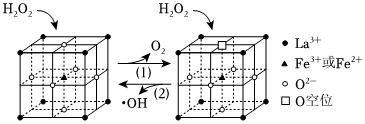
(2)烟气中的NO与O2反应缓慢。雾化后的H2O2在催化剂中Fe元素作用下可以产生具有极强氧化活性的•OH(羟基自由基),OH能将NO快速氧化为NO2、HNO3等物质。H2O2在一种固体催化剂表面转化的过程如图所示:
①脱硝时,NO2与吸收液中(NH4)2SO3反应生成(NH4)2SO4,同时排放出的气体不会污染空气。写出脱硝时NO2与(NH4)2SO3反应的化学方程式:2NO2+4(NH4)2SO3=4(NH4)2SO4+N22NO2+4(NH4)2SO3=4(NH4)2SO4+N2。
②如图转化(1)的过程可以描述为 H2O2失去电子被氧化为O2,Fe3+得到电子后被还原为Fe2+,晶体中部分O原子失去后形成氧空位H2O2失去电子被氧化为O2,Fe3+得到电子后被还原为Fe2+,晶体中部分O原子失去后形成氧空位。
③化学式为LaFeO2.6的催化剂中,Fe3+和Fe2+的物质的量之比为 1:41:4。
④其他条件一定,比较等物质的量LaFeO2.6与LaFeO2.8催化效果并说明理由 LaFeO2.6催化效果好,因为LaFeO2.6中含Fe2+(或氧空位)的物质的量更多,与H2O2反应时生成的•OH更多LaFeO2.6催化效果好,因为LaFeO2.6中含Fe2+(或氧空位)的物质的量更多,与H2O2反应时生成的•OH更多。
(3)如不使用固体催化剂,用含Fe3+的溶液也能催化H2O2发生类似的转化生成•OH,且相同条件下速率更快。与使用含Fe3+的溶液相比,使用固体催化剂的优点是 对反应的pH没有要求,反应后无需处理含Fe2+、Fe3+的废液对反应的pH没有要求,反应后无需处理含Fe2+、Fe3+的废液。
【答案】30~60℃时升高温度,CO(NH2)2水解生成(NH4)2CO3的速率加快,溶液中(NH4)2CO3的浓度增大,且升高温度可加快反应速率;60~70℃时SO2在溶液中的溶解量减少,反应速率减慢;2NO2+4(NH4)2SO3=4(NH4)2SO4+N2;H2O2失去电子被氧化为O2,Fe3+得到电子后被还原为Fe2+,晶体中部分O原子失去后形成氧空位;1:4;LaFeO2.6催化效果好,因为LaFeO2.6中含Fe2+(或氧空位)的物质的量更多,与H2O2反应时生成的•OH更多;对反应的pH没有要求,反应后无需处理含Fe2+、Fe3+的废液
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/31 8:0:9组卷:83引用:1难度:0.5
相似题
-
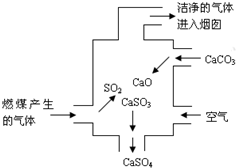 1.右图是某燃煤发电厂处理废气的装置示意图.装置内发生的主要反应中不含( )发布:2024/12/30 4:0:1组卷:331引用:16难度:0.9
1.右图是某燃煤发电厂处理废气的装置示意图.装置内发生的主要反应中不含( )发布:2024/12/30 4:0:1组卷:331引用:16难度:0.9 -
2.下列说法不正确的是( )
发布:2024/12/30 5:30:2组卷:27引用:2难度:0.9 -
3.工业上常用微生物法、吸收法、电解法、还原法等消除硫、氮等引起的污染。
(1)微生物法脱硫
富含有机物的弱酸性废水在SBR细菌作用下产生CH3COOH、H2等物质,可将废水中还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。SO2-4
①的空间构型为SO2-4.
②CH3COOH与在SBR细菌作用下生成CO2和H2S的离子方程式为SO2-4.
③将H2S从水中吹出时,用CO2比N2效果更好,其原因是.
(2)吸收法脱硫
烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为(NH4)2SO3+SO2+H2O═2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图-1所示.b点时溶液pH=7,则n():n(NH+4)=HSO-3.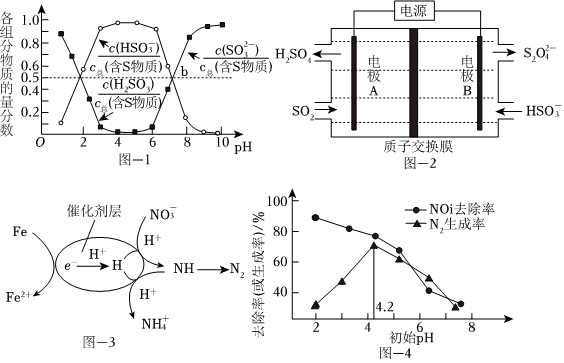
(3)电解法脱硫
用NaOH吸收后SO2,所得NaHSO3溶液经电解后可制取Na2S2O4溶液,反应装置如图-2所示。电解时每有1molS2生成有O2-4molH+透过质子交换膜。
(4)还原法脱氮
用催化剂协同纳米零价铁去除水体中。其催化还原反应的过程如图-3所示。NO-3
①该反应机理中生成N2的过程可描述为.
②过程中去除率及N2生成率如图-4所示,为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是NO-3。发布:2024/12/30 5:30:2组卷:43引用:4难度:0.5


