硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合价为 -1-1。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有 DD(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 99.75%99.75%。
(4)工业生产中常用氨酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理(只写出2个方程式即可) SO2+2NH3•H2O═(NH4)2SO3SO2+2NH3•H2O═(NH4)2SO3、(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O。
【考点】工业制取硫酸.
【答案】-1;D;99.75%;SO2+2NH3•H2O═(NH4)2SO3;(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/12 9:0:8组卷:33引用:1难度:0.5
相似题
-
1.关于工业上用接触法制硫酸的说法不正确的是( )
发布:2024/12/30 5:30:2组卷:28引用:3难度:0.7 -
2.硫酸在化工生产国民经济发展中占有极其重要的地位,如图是工业接触法制硫酸的简单流程图。
试回答下列有关问题: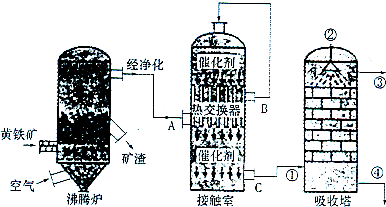
(1)写出工业上用FeS2制取SO2的化学方程式;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、;
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在,在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是;
(4)硫酸工厂形成的“三废”对环境有较大的影响,处理硫酸工厂尾气的化学方程式是;
(5)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫;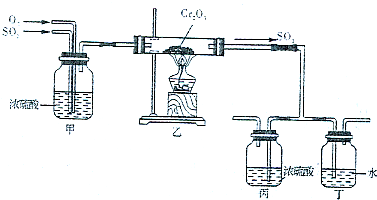
①若丁装置在反应过程中出现气泡,不久就出现了自雾,而丙装置一直没有明显变化,丁装置产生白雾的原因是,此现象对工业上制硫酸带来的不良后果是;
②上图中的乙装置和丙装置分别与工业制取硫酸的某个装置相对应,其中乙装置对应的是接触室; 丙装置对应的是。发布:2024/12/30 6:0:2组卷:13引用:2难度:0.5 -
3.有关接触法制硫酸的叙述.其中不正确的是( )
发布:2024/12/30 6:0:2组卷:26引用:3难度:0.7


