请阅读下列资料,回答问题。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为 MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置 丙丙(填“甲”“乙”或“丙”)。
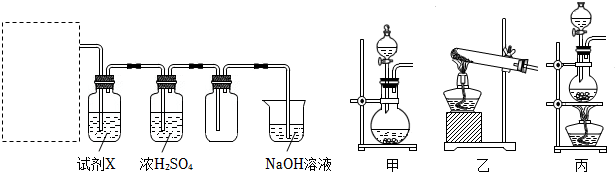
试剂X是 饱和NaCl溶液饱和NaCl溶液。可用NaOH溶液吸收尾气,反应的离子方程式为 Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O。
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是 次氯酸分解生成盐酸,使溶液的酸性增强次氯酸分解生成盐酸,使溶液的酸性增强,请在图2中画出氧气的体积随时间变化的趋势图 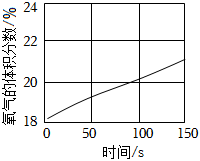 。
。
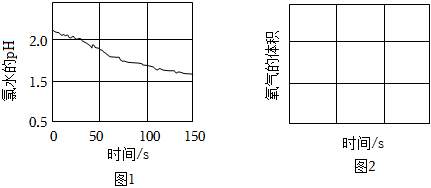
(3)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(NaClO2)溶液可制备新的绿色消毒剂二氧化氯(ClO2),反应中还可得到氯化钠。该反应的化学方程式为 Cl2+2NaClO2=2ClO2+2NaClCl2+2NaClO2=2ClO2+2NaCl。
(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为:3ClO-+2Fe3++10OH-=2FeO2-4+3Cl-+5H2O。在该反应中,若有2molFeO2-4生成,则转移的电子数为 66NA。
△
△
F
e
O
2
-
4
mol
F
e
O
2
-
4
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;丙;饱和NaCl溶液;Cl2+2OH-=Cl-+ClO-+H2O;次氯酸分解生成盐酸,使溶液的酸性增强;Cl2+2NaClO2=2ClO2+2NaCl;6
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/21 3:0:11组卷:15引用:2难度:0.6
相似题
-
1.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
2.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
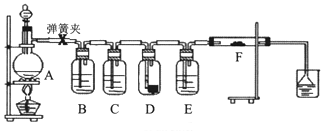
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


