金属及其化合物在生产生活中有广泛的应用。
(一)金属的特性与应用
(1)句容人葛洪在《抱朴子内篇•黄白》中有“以曾青涂铁,铁赤色如铜”的记载,其中蕴含化学含意的化学方程式为 Fe+CuSO4=Cu+FeSO4Fe+CuSO4=Cu+FeSO4。
(2)“航母”用钢要具有低磁性。下列具有磁性的是 BB。(填序号)
A.FeO
B.Fe3O4
C.Fe2O3
(3)“航母”螺旋桨可由特制的铜合金制造。铜比铁在海水中耐腐蚀的原因是 铜的金属活动性比铁弱铜的金属活动性比铁弱。
(4)生铁炼钢时,硅(Si)与氧化亚铁在高温条件下转化为二氧化硅和铁,该反应的化学方程式为 Si+2FeO 高温 SiO2+2FeSi+2FeO 高温 SiO2+2Fe。
(5)碱式碳酸铝镁Mg6Al2(OH)12CO3•4H2O是一种新型塑料阻燃剂,其受热分解生成熔点较高的MgO和Al2O3,其阻燃原理是 bb。
a.分解吸热,降低可燃物着火点
b.MgO、Al2O3等覆盖燃烧物,隔绝氧气
(二)铁红(Fe2O3)的制备
用工业烧渣(含有Fe2O3、FeO和SiO2)制备化工原料铁红的实验流程如图:
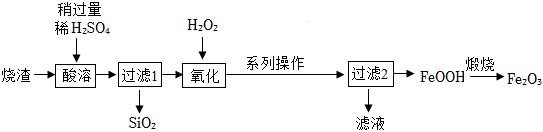
(6)酸溶前将烧渣粉碎,目的是 增大反应的接触面积,加快反应速率增大反应的接触面积,加快反应速率。
(7)氧化时FeSO4在酸性条件下,被H2O2氧化成Fe2(SO4)3,该反应的化学方程式是 2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O。反应温度不宜太高,原因是 温度过高,H2O2受热分解温度过高,H2O2受热分解。
(8)FeOOH焙烧反应的化学方程式是 2FeOOH 焙烧 Fe2O3+H2O2FeOOH 焙烧 Fe2O3+H2O。
(三)铁矿石的组成研究
碱式碳酸亚铁是工业上冶炼铁的一种矿物,为测定碱式碳酸亚铁【xFeCO3•yFe(OH)2•zH2O】的组成,同学们在老师的指导下称取3.58g碱式碳酸亚铁粉末进行了如下的探究:
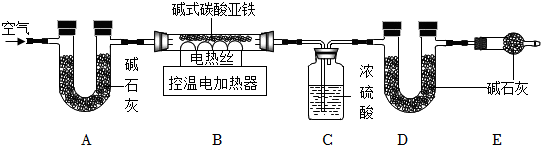
【查阅资料】
①碱式碳酸亚铁受热会完全分解生成FeO、CO2以及H2O。
②浓硫酸可以吸收H2O,碱石灰可以吸收CO2和H2O。
【实验步骤】
(9)装配好实验装置后,先要 检查装置的气密性检查装置的气密性。
(10)加热前后都要通一段时间空气,装置A的作用 除去空气中的CO2和H2O除去空气中的CO2和H2O。加热后通一段时间空气的目的是 使反应生成的CO2和H2O完全被吸收使反应生成的CO2和H2O完全被吸收。
充分反应后,准确称量装置C、D的质量,所得数据如表:
高温
高温
焙烧
焙烧
| 装置C/g | 装置D/g | |
| 加热前 | 100.00 | 120.00 |
| 加热后 | 100.54 | 120.88 |
(11)据表中数据分析,可计算出B中剩余固体的质量为
2.16g
2.16g
。xFeCO3•yFe(OH)2•zH2O中,x:y:z=2:1:2
2:1:2
。【答案】Fe+CuSO4=Cu+FeSO4;B;铜的金属活动性比铁弱;Si+2FeO SiO2+2Fe;b;增大反应的接触面积,加快反应速率;2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O;温度过高,H2O2受热分解;2FeOOH Fe2O3+H2O;检查装置的气密性;除去空气中的CO2和H2O;使反应生成的CO2和H2O完全被吸收;2.16g;2:1:2
高温
焙烧
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/31 10:0:8组卷:165引用:1难度:0.4
相似题
-
 1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
(1)米、面的主要成分都是由三种元素组成的淀粉,淀粉属于糖类.
(2)水瓶内的水垢主要成分是碳酸钙,可用(填一种调味品)除去.
(3)白糖与红糖主要成分都是蔗糖.利用活性炭的性,可将红糖脱色成白糖.
(4)市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,其目的是防止食品而变质.
(5)味精是烹制菜肴时常用的调味品,小明研究某品牌味精包装上的部分文字说明后,想测定此味精中氯化钠的含量.
[查阅资料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠的存在不影响NaCl性质.
[实验过程]
①称取该味精样品10.0g,并溶于蒸馏水
②加入过量的硝酸银溶液,过滤
③用蒸馏水反复洗涤沉淀多次
④将沉淀烘干、称量,测得固体质量为5.74g
根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是.
②试通过计算确定此样品中NaCl质量分数与其包装上标注的含量是否相符.发布:2025/1/6 8:0:1组卷:68引用:2难度:0.5 -
2.化学兴趣小组同学们在老师的指导下对市售某品牌“钙片”的补钙原理、成分以及功效展开了项目化学习的探究。
【查阅资料】
(1)该补钙剂的主要成分有碳酸钙、维生素D3、硫酸锌、水果香料等。
(2)维生素D3、水果香料都不溶于水也不与酸反应,维生素D3主要作用是促进人体对钙的吸收。
项目一:探究“钙片”补钙原理。
【分析交流】
“钙片”中钙以碳酸钙形式存在,“钙片”进入胃首先要通过人体胃酸对其进行溶解后方可被吸收。
【进行实验】
【反思评价】服用“钙片”时,采用实验方案 实验现象 实验结论或化学方程式 取适量“钙片”粉末于试管中,滴加足量 。化学方程式 (填“吞服”或“嚼服”)的服药方式更有利促进胃肠吸收。
项目二:探究“钙片”中是否含有硫酸锌。
项目三:探究“钙片”的功效。实验方案 实验现象 实验结论 另取少量“钙片”粉末于试管中,加足量水,充分溶解,取适量上层清液于试管中,加入几滴 。“钙片”中含有硫酸锌。
【交流讨论】
该补钙剂适用于中老年人治疗因缺钙导致的患者。老师建议大家应注意平时的饮食补钙,牛奶、鱼类等食物除富含营养素外,是较好的补钙食物,应该多食用。发布:2025/1/3 16:0:5组卷:30引用:1难度:0.5 -
 3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
(1)造纸业会产生大量含NaOH的碱性废水,需经处理至中性排放。
①写出NaOH的俗称:(一个即可)。
②若某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸9.8t(H2SO4的质量分数为10%)。可以处理的废水质量为t。
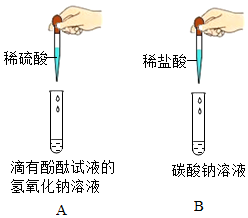
(2)某化学兴趣小组做了如图所示的两个实验。完成A、B两个实验后,同学们将实验后的废液倾倒入一个废液缸中,发现废液呈红色,小组同学对废液成分展开了如下探究。(该题实验过程中所用溶液浓度较低;氯化钙溶液和氯化钡溶液显中性;实验中如涉及硫酸钙、氢氧化钙等微溶物,均可看做可溶物)
【交流讨论】小组同学经讨论分析后一致认为废液中一定含有的溶质有氯化钠和(酚酞除外)。
【提出猜想】废液中还含有的物质:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化学式)。
【实验验证】
甲同学取少量废液于试管中,向其中加入过量的氯化钙溶液,通过观察现象,得出了正确结论。若猜想二正确,甲同学观察到的现象:有白色沉淀生成,;请写出发生反应的化学方程式:。
【交流与反思】乙同学认为,将甲同学实验中的氯化钙溶液换成氯化钡溶液,也能得出正确结论。你认为乙同学的观点是否正确并说明你的理由:。发布:2025/1/3 8:0:1组卷:93引用:1难度:0.5


