【科学探究】
学习了二氧化锰对过氧化氢溶液分解有催化作用的知识后,同学们对催化剂产生了兴趣,他们开展了以下探究。
实验探究一:比较催化剂种类对过氧化氢溶液分解的影响

【查阅资料】
(1)很多植物对过氧化氢溶液的分解有催化作用。
(2)压强传感器可以测量密闭体系内气体压强的变化。
【实验操作】
(1)在27.8℃,100.7kPa时,将具支试管的支管通过胶皮管与压强传感器连接(如图1所示),取2.0g植物碎末放入具支试管中。
(2)用量筒量取2mL3%过氧化氢溶液,倒入具支试管中并立即塞上橡胶塞,同时启动数据采集程序采集数据。更换相同质量,不同种类的植物碎末,重复实验(1)和(2)。
(3)不加入植物碎末,重复实验(1)和(2),做空白实验。
(4)将采集到的数据用电脑进行处理,得到反应前后压强随时间变化曲线如图2。实验操作(3)的目的是 作对比实验,便于比较催化剂对过氧化氢分解速率的影响作对比实验,便于比较催化剂对过氧化氢分解速率的影响。
【实验结论1】由图2可知,催化效果最好的是 上海青叶上海青叶。
【交流反思】上海青叶作催化剂时,200s前曲线迅速升高的原因是:上海青叶作催化剂,加快过氧化氢分解,分解速率大,产生了大量氧气,且同时放出热量,温度升高,所以压强快速增加上海青叶作催化剂,加快过氧化氢分解,分解速率大,产生了大量氧气,且同时放出热量,温度升高,所以压强快速增加;200s后曲线略有下降的原因是 过氧化氢分解是放热反应,反应结束后,气体的质量不变,但温度下降,随着温度下降,压强逐渐降低过氧化氢分解是放热反应,反应结束后,气体的质量不变,但温度下降,随着温度下降,压强逐渐降低。除此之外,你还可以从图2中得出的结论是:同种植物的不同部位,催化效果不一样同种植物的不同部位,催化效果不一样。
实验探究二:比较催化剂用量对过氧化氢溶液分解的影响
【进行实验】
在30.2℃,压强100.5kPa时,选择上海青叶碎末用量分别为1g、2g、3g,均与2mL3%过氧化氢溶液反应,获得数据如图3所示。
【实验结论2】
由图3可知,在t秒内,上海青叶用量为 2g2g时,过氧化氢溶液分解速率最快;图中三条曲线最终将重合在一起,其理由是 催化剂只能改变反应速率,不会对生成物的质量有影响,因参加反应的过氧化氢的质量相同,最终生成氧气的质量也相同催化剂只能改变反应速率,不会对生成物的质量有影响,因参加反应的过氧化氢的质量相同,最终生成氧气的质量也相同。
【拓展延伸】
某些植物、氧化铜、猪肝、二氧化锰等都可以做过氧化氢溶液分解的催化剂、除此以外,硫酸铜也可以作过氧化氢溶液分解的催化剂。
【答案】作对比实验,便于比较催化剂对过氧化氢分解速率的影响;上海青叶;上海青叶作催化剂,加快过氧化氢分解,分解速率大,产生了大量氧气,且同时放出热量,温度升高,所以压强快速增加;过氧化氢分解是放热反应,反应结束后,气体的质量不变,但温度下降,随着温度下降,压强逐渐降低;同种植物的不同部位,催化效果不一样;2g;催化剂只能改变反应速率,不会对生成物的质量有影响,因参加反应的过氧化氢的质量相同,最终生成氧气的质量也相同
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/22 9:0:8组卷:26引用:1难度:0.5
相似题
-
 1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
(1)请结合上述介绍将表中空格补充完整。
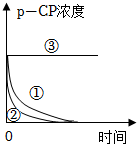
(2)实验测得p-CP的浓度随时间变化的关系如图所示,根据实验①、②图像可得出结论:实验编号 实验目的 温度/℃
pH浓度/(mg•L﹣1) H2O2 Fe2+ ① 为②③提供参照 25 3 204 16.8 ② 探究温度对降解反应速率的影响
3 204 16.8 ③ 探究溶液pH对降解反应速率的影响 25 10 204 16.8 。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据本题信息,将样品从反应器中取出后应立即将其放入某药品中,反应会迅速停止,该药品可能是。
A盐酸溶液 B氢氧化钠溶液 C稀硫酸溶液 D碳酸钠溶液发布:2024/11/25 8:0:2组卷:3引用:0难度:0.3 -
2.据图1装置图回答问题
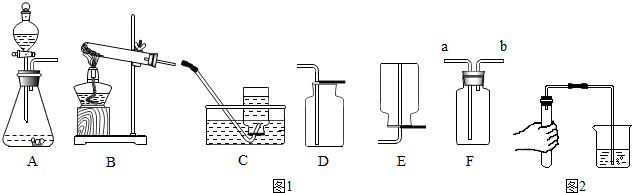
(1)甲同学用氯酸钾和二氧化锰共热制备和收集氧气,他应选用的气体发生装置是(填序号).他用装置C来收集的原因是,当看到导管口的时他才开始收集氧气.
(2)该同学用如图2所示的方法进行气密性检查,如果装置不漏气,可以看到,将手松开一段时间后(导管仍插入水中),可以看到导管中会形成一段水柱.
(3)因为氧气的密度比空气的稍大,所以还可以选用(填序号)来收集氧气,其验满的方法是.
(4)老师提醒可以用F(万能瓶)来收集气体,则甲同学应将发生装置的导管与F的导管(选填a或b)相连接.
(5)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,这位同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的二氧化锰(MnO2)分解放出O2;
猜想Ⅱ:反应生成的锰酸钾(K2MnO4)分解放出O2;
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想(选填Ⅰ或Ⅱ)错误;
第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是.
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?.
(6)丙同学选择用双氧水和二氧化锰混合来制氧气,则他应选用的气体发生装置是(填序号).以下是他探究影响该反应速率因素的相关实验数据.
通过以上实验数据的分析,可知,过氧化氢分解制氧气的化学反应速率与实验
序号H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2用量/g 收集到的
氧气体积/mL反应所需的
时间/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有关;发生装置中的(填仪器名称)也可以帮助控制反应的速率.发布:2024/12/18 8:0:1组卷:12引用:2难度:0.5 -
3.下列探究影响化学反应速率因素的实验中,实验方案正确的是( )
选项 影响因素 实验方案 A 接触面积 将1g块状石灰石和20mL10%的稀盐酸、1g粉末状石灰石与20mL10%的稀硫酸混合,比较产生气泡的快慢 B 催化剂的种类 将0.5g二氧化锰、1g氧化铁分别与10mL6%的过氧化氢溶液混合,比较产生气泡的快慢 C 反应物的种类 分别将木炭在空气中、氧气中燃烧,比较反应的剧烈程度 D 反应物的性质 分别用酒精灯加热表面积相同的镁片和铁片,比较在空气中能否被点燃 发布:2024/12/25 13:0:1组卷:114引用:4难度:0.7


