地球上的金属资源广泛地存在于地壳和海洋中,除金、银等少数很不活泼的金属主要以单质形式存在外,其余都以化合物的形式存在。
(1)高铁酸钾为紫色固体,极易溶于水,微溶于浓KOH溶液,难溶于有机溶剂;在酸性、中性溶液中易分解放出O2,在0∼5℃、强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取K2FeO4并探究其性质。回答下列问题:
Ⅰ.制取K2FeO4
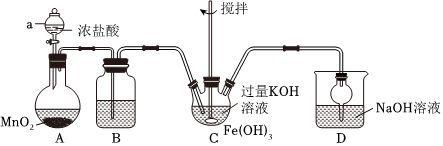
①仪器a的名称是 分液漏斗分液漏斗,装置D的作用是 Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示)。
②装置C中反应的化学方程式为 2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。
③装置C中反应为放热反应,控制反应温度在0~5℃的方法是 冰水浴冰水浴。
Ⅱ.探究K2FeO4性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。
④Cl2生成的可能原因:a.FeO2-4氧化Cl-;b.Cl2+2OH-=Cl-+ClO-+H2O、Cl-+ClO-+2H+=Cl2↑+H2OCl2+2OH-=Cl-+ClO-+H2O、Cl-+ClO-+2H+=Cl2↑+H2O(用离子方程式表示)。
为探究Cl2产生的原因,设计以下方案:
F
e
O
2
-
4
| 方案甲 | 取少量溶液a,滴加KSCN溶液至过量,溶液量红色 |
| 方案乙 | 用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将K2FeO4溶解,得紫色溶液b。取少量溶液b,滴加盐酸,有Cl2产生 |
Fe3+
Fe3+
(填离子符号),但该离子不一定是K2FeO4将Cl-氧化所得,还可能由 4+2OH-═4Fe3++3O2↑+10H2O
F
e
O
2
-
4
4+2OH-═4Fe3++3O2↑+10H2O
产生(用离子方程式表示)。方案乙可证明酸性条件下F
e
O
2
-
4
F
e
O
2
-
4
⑤某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mLCl2,恰好将Fe2+完全氧化,x值为
0.8
0.8
。(需在答题纸上写出计算过程)(2)如图是Na2O2和CO2定性、定量实验的装置示意图。注射器1中抽取了100mLCO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U形管中,注射器2活塞缓缓向外移动。下列叙述中不正确的是
C
C
(填选项序号)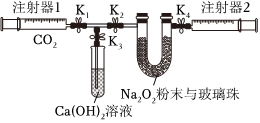
A.U形管内的玻璃珠可增大过氧化钠与二氧化碳的接触面积
B.U形管内淡黄色粉末渐渐变白
C.注射器1活塞推到底后,注射器2中收集到的气体大于50mL,只是因为还含有CO2
D.打开胶塞,立即将带火星的木条伸入U形管中,可验证反应产物之一为氧气
(3)某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示,求原混合溶液H2SO4和HNO3的浓度。
4mol/L、2mol/L
4mol/L、2mol/L
(需在答题纸上写出计算过程)
【答案】分液漏斗;Cl2+2OH-=Cl-+ClO-+H2O;2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O;冰水浴;Cl2+2OH-=Cl-+ClO-+H2O、Cl-+ClO-+2H+=Cl2↑+H2O;Fe3+;4+2OH-═4Fe3++3O2↑+10H2O;0.8;C;4mol/L、2mol/L
F
e
O
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/10 7:0:2组卷:16引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
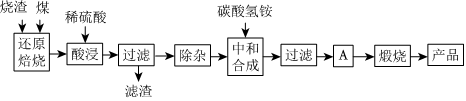
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
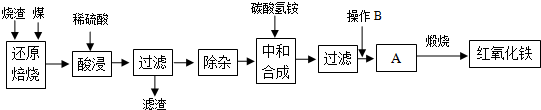
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
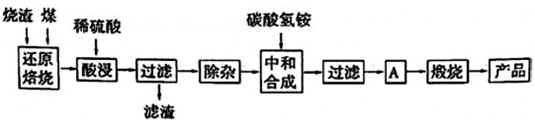
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


