Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol•L-1NH4Al(SO4)2溶液中的c(NH+4) 小于小于(填“等于”“大于”或“小于”)0.1mol•L-1NH4HSO4溶液中的c(NH+4)。
(2)室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
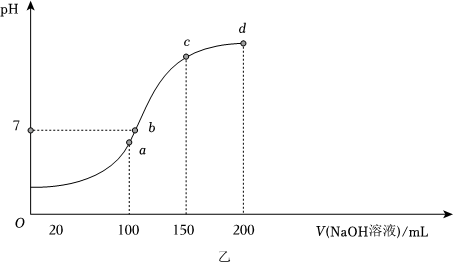
试分析图中a、b、c、d四个点,水的电离程度最大的是 aa点。在b点,溶液中各离子浓度由大到小的排列顺序是 c(Na+)>c(SO2-4)>c(NH+4)>c(H+)=c(OH-)c(Na+)>c(SO2-4)>c(NH+4)>c(H+)=c(OH-)。
Ⅱ.难溶电解质的沉淀溶解平衡及其溶度积常数在生产、科研等领域有着诸的应用。25℃时,各物质的溶度积如下表所示:
NH
+
4
NH
+
4
SO
2
-
4
NH
+
4
SO
2
-
4
NH
+
4
| 难溶电解质 | AgCl | AgBr | AgI | BaSO4 |
| Ksp | 1.8×10-10 | 4.9×10-13 | 8.3×10-17 | 1×10-10 |
①>②>④>③
①>②>④>③
(填序号)。(4)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
c
(
I
-
)
c
(
C
l
-
)
4.6×10-7
4.6×10-7
。(5)钡餐是医学检查肠胃的常用造影剂。当人体中Ba2+浓度达到2×10-3mol•L-1时会影响健康,若有人误服氯化钡,请回答能通过服用5%的硫酸钠溶液有效除去胃中的Ba2+的理由
5%的硫酸钠物质的量浓度约0.36mol•L-1,则此时溶液中Ba2+离子的浓度为3×10-10mol/L远远小于影响健康的Ba2+离子浓度
5%的硫酸钠物质的量浓度约0.36mol•L-1,则此时溶液中Ba2+离子的浓度为3×10-10mol/L远远小于影响健康的Ba2+离子浓度
(已知:5%的硫酸钠溶液物质的量浓度约0.36mol•L-1)。【答案】小于;a;c(Na+)>c()>c()>c(H+)=c(OH-);①>②>④>③;4.6×10-7;5%的硫酸钠物质的量浓度约0.36mol•L-1,则此时溶液中Ba2+离子的浓度为3×10-10mol/L远远小于影响健康的Ba2+离子浓度
SO
2
-
4
NH
+
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/10 9:0:2组卷:15引用:2难度:0.6


