含SO2废气的治理可以变废为宝,使硫资源得以利用。
(1)下列物质中,能吸收SO2的有 ABAB(填字母)。
A.氨水
B.酸性KMnO4溶液
C.浓硫酸
D.Na2SO3溶液
(2)在400℃时,将一定比例SO2和H2的混合气体以一定流速通过装有Fe2O3/Al2O3负载型催化剂(其中Fe2O3为催化剂,Al2O3为载体)的反应器可消除SO2的污染,生成单质S。研究表明,该过程中实际起催化作用的是反应初期生成的FeS2,催化过程中检测到有H2S。FeS2催化的过程可描述如下:FeS2与H2反应生成FeS和H2S,H2S再与SO2反应生成S和H2OFeS2与H2反应生成FeS和H2S,H2S再与SO2反应生成S和H2O,最后S再与FeS反应转化为FeS2。
(3)如图是一种综合处理SO2废气的工艺流程。
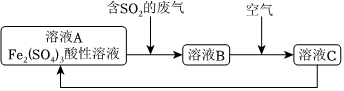
Fe2(SO4)3酸性溶液转化为溶液B发生反应的离子方程式为 2Fe3++2H2O+SO2=2Fe2++SO2-4+4H+2Fe3++2H2O+SO2=2Fe2++SO2-4+4H+。
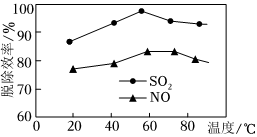
(4)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除废气中的NOx、SO2,使其转化为NO-3、SO2-4。如图表示在一定条件下,复合吸收剂对烟气中SO2、NO的脱除效率随温度变化的关系,图中SO2比NO脱除效率高的原因可能是 SO2易溶于水,而NO难溶于水,导致吸收剂中SO2浓度明显比NO大,则SO2比NO脱除效率高(或SO2的还原性或脱硝反应活化能较高)SO2易溶于水,而NO难溶于水,导致吸收剂中SO2浓度明显比NO大,则SO2比NO脱除效率高(或SO2的还原性或脱硝反应活化能较高)。
(5)“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收废气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如图:
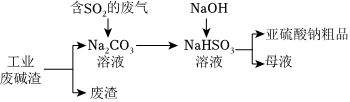
①流程中Na2CO3溶液吸收SO2生成CO2,该反应的化学方程式为 2SO2+Na2CO3+H2O=2NaHSO3+CO22SO2+Na2CO3+H2O=2NaHSO3+CO2。
②设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加入过量盐酸,再加入BaCl2溶液,出现白色沉淀,则证明含有Na2SO4在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加入过量盐酸,再加入BaCl2溶液,出现白色沉淀,则证明含有Na2SO4。(必须使用的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
SO
2
-
4
SO
2
-
4
N
O
-
3
S
O
2
-
4
【答案】AB;FeS2与H2反应生成FeS和H2S,H2S再与SO2反应生成S和H2O;2Fe3++2H2O+SO2=2Fe2+++4H+;SO2易溶于水,而NO难溶于水,导致吸收剂中SO2浓度明显比NO大,则SO2比NO脱除效率高(或SO2的还原性或脱硝反应活化能较高);2SO2+Na2CO3+H2O=2NaHSO3+CO2;在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加入过量盐酸,再加入BaCl2溶液,出现白色沉淀,则证明含有Na2SO4
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/11 8:0:9组卷:74引用:3难度:0.5
相似题
-
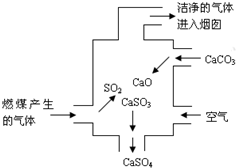 1.右图是某燃煤发电厂处理废气的装置示意图.装置内发生的主要反应中不含( )发布:2024/12/30 4:0:1组卷:331引用:16难度:0.9
1.右图是某燃煤发电厂处理废气的装置示意图.装置内发生的主要反应中不含( )发布:2024/12/30 4:0:1组卷:331引用:16难度:0.9 -
2.下列说法不正确的是( )
发布:2024/12/30 5:30:2组卷:27引用:2难度:0.9 -
3.工业上常用微生物法、吸收法、电解法、还原法等消除硫、氮等引起的污染。
(1)微生物法脱硫
富含有机物的弱酸性废水在SBR细菌作用下产生CH3COOH、H2等物质,可将废水中还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。SO2-4
①的空间构型为SO2-4.
②CH3COOH与在SBR细菌作用下生成CO2和H2S的离子方程式为SO2-4.
③将H2S从水中吹出时,用CO2比N2效果更好,其原因是.
(2)吸收法脱硫
烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为(NH4)2SO3+SO2+H2O═2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图-1所示.b点时溶液pH=7,则n():n(NH+4)=HSO-3.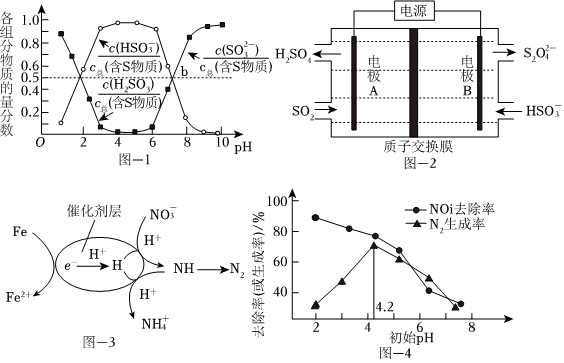
(3)电解法脱硫
用NaOH吸收后SO2,所得NaHSO3溶液经电解后可制取Na2S2O4溶液,反应装置如图-2所示。电解时每有1molS2生成有O2-4molH+透过质子交换膜。
(4)还原法脱氮
用催化剂协同纳米零价铁去除水体中。其催化还原反应的过程如图-3所示。NO-3
①该反应机理中生成N2的过程可描述为.
②过程中去除率及N2生成率如图-4所示,为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是NO-3。发布:2024/12/30 5:30:2组卷:43引用:4难度:0.5


