Ⅰ.氯气既是实验室中的一种重要试剂,也是工业生产中的一种重要原料,含氯化合物在工农业生产和日常生活中用途十分广泛。
(1)工业上对氯气的需求量很大。常利用电解饱和食盐水的方法来制取氯气,该反应的化学方程式为 2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑。
Ⅱ.某同学在实验室里,利用以下装置制取漂白粉:

(2)写出装置A中发生反应的化学方程式,并用双线桥表示电子转移情况 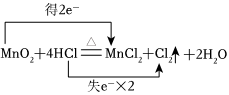
 。
。
(3)装置B中饱和食盐水的作用是 除去Cl2中的HCl杂质除去Cl2中的HCl杂质。
(4)装置C中制取漂白粉的化学方程式为 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(5)已知制取漂白粉的反应是一个放热反应。该同学在实验中发现所制得漂白粉的有效成分偏低,经查阅资料分析发现,主要原因是在较高温度下发生副反应6Cl2+6Ca(OH)2 △ 5CaCl2+Ca(ClO3)2+6H2O,该副反应中氧化产物和还原产物的物质的量之比为 1:51:5。为减少此副反应的发生,可采取的具体措施是 把B装置放入冷水中把B装置放入冷水中。
(6)用8.7gMnO2固体与足量浓盐酸反应,理论上最多可生成Cl2气体体积(标准状况下)为 2.242.24L。
【知识应用】
某化工厂不慎发生了氯气泄漏事故,泄漏的氯气迅速向周围的居民区蔓延。
(7)如果你当时在现场,你应该往 高坡上高坡上(填“高坡上”或“低洼处”)撤离。
通电
通电


△
【答案】2NaCl+2H2O 2NaOH+H2↑+Cl2↑; ;除去Cl2中的HCl杂质;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;1:5;把B装置放入冷水中;2.24;高坡上
;除去Cl2中的HCl杂质;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;1:5;把B装置放入冷水中;2.24;高坡上
通电
 ;除去Cl2中的HCl杂质;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;1:5;把B装置放入冷水中;2.24;高坡上
;除去Cl2中的HCl杂质;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;1:5;把B装置放入冷水中;2.24;高坡上【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/4 8:0:5组卷:14引用:2难度:0.7
相似题
-
1.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:21引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:21引用:2难度:0.8 -
2.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
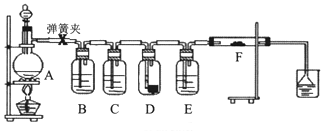
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
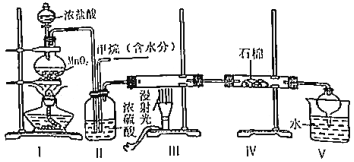 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


