弱电解质的研究是重要课题。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不正确的是 cc。
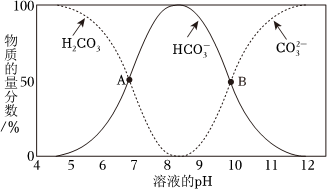
a.pH=8时,溶液中含碳元素的微粒主要是HCO-3
b.A点,溶液中H2CO3和HCO-3浓度相同
c.当c(HCO-3)=c(CO2-3)时,c(H+)>c(OH-)
d.该温度下,H2CO3的第二步电离常数Ka2约为1×10-10
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是 HCO-3+OH-=CO2-3+H2OHCO-3+OH-=CO2-3+H2O。
(2)已知在25℃时,醋酸、次氯酸、NH3•H2O、碳酸和亚硫酸的电离平衡常数分别为:
HC
O
-
3
HC
O
-
3
HC
O
-
3
C
O
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
CO
2
-
3
| 电解质 | 醋酸 | 次氯酸 | NH3•H2O | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K=1.75×10-5 | K=2.95×10-8 | K=1.8×10-5 | K1=4.0×10-7 K2=5.0×10-11 |
K1=1.54×10-2 K2=1.02×10-7 |
B
B
。A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-=
HC
O
-
3
B.少量SO2通入次氯酸钙溶液中:2ClO-+SO2+H2O=
S
O
2
-
3
C.Na2CO3溶液中加入足量NaHSO3溶液:
C
O
2
-
3
HS
O
-
3
HC
O
-
3
S
O
2
-
3
D.少量CO2通入亚硫酸钠溶液中:
S
O
2
-
3
HS
O
-
3
HC
O
-
3
(3)如表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积Kw | 1×10-14 | a | 1×10-12 |
①若25<t1<t2,则a
>
>
1×10-14(填“>”“<”或“=”)。②25℃时,某Na2SO4溶液中c(
S
O
2
-
4
1000:1
1000:1
。③t2℃下,pH=2的HCl溶液与pH=5的H2SO4的溶液等体积混合后,混合溶液的pH=
2.3
2.3
。(已知lg2=0.3)④t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
9:11
9:11
。【答案】c;+OH-=+H2O;B;>;1000:1;2.3;9:11
HCO
-
3
CO
2
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/12 3:0:1组卷:20引用:2难度:0.6


