 实验室以活性炭为催化剂,用CoCl2制取[Co(NH3)6]Cl3,装置如图所示。
实验室以活性炭为催化剂,用CoCl2制取[Co(NH3)6]Cl3,装置如图所示。
(1)仪器a的名称是 恒压滴液漏斗恒压滴液漏斗;
仪器b中的试剂是 无水CaCl2或P2O5无水CaCl2或P2O5;
冷凝管作用是 冷凝回流冷凝回流。
将0.1mol/LCoCl2、NH4Cl混合液在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色。已知:①[Co(NH3)6]2+具有较强还原性;溶液呈棕色。②Ksp[Co(OH)2]=6×10-15
(2)请计算常温下该混合液中Co2+开始沉淀的pH值(精确到0.01),列出必要过程。 Ksp[Co(OH)2]=c(Co2+)c2(OH-)=6×10-15,c(OH-)=2.45×10-7mol/L,c(H+)=Kwc(OH-)=4.08×10-8mol/L,pH=-lgc(H+)=-lg4.08×10-8≈7.39,调节溶液的pHKsp[Co(OH)2]=c(Co2+)c2(OH-)=6×10-15,c(OH-)=2.45×10-7mol/L,c(H+)=Kwc(OH-)=4.08×10-8mol/L,pH=-lgc(H+)=-lg4.08×10-8≈7.39,调节溶液的pH。NH4Cl的作用是 调节溶液的pH,防止生成Co(OH)2沉淀调节溶液的pH,防止生成Co(OH)2沉淀。
(3)充分反应后缓慢滴加双氧水,水浴加热20min(该过程生成OH-)。发生反应的离子方程式为 2[Co(NH3)6]2++H2O2+2NH+4 △ 2[Co(NH3)6]3++2NH3+2H2O2[Co(NH3)6]2++H2O2+2NH+4 △ 2[Co(NH3)6]3++2NH3+2H2O。
将反应后的混合液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。已知[Co(NH3)6]Cl3可溶于热水,微溶于冷水,难溶于乙醇。
(4)请运用平衡移动原理解释加入浓盐酸的目的是 [Co(NH3)6]Cl3⇌[Co(NH3)6]3++3Cl-,加入浓盐酸,c(Cl-)增大,平衡逆向移动,有利于晶体析出[Co(NH3)6]Cl3⇌[Co(NH3)6]3++3Cl-,加入浓盐酸,c(Cl-)增大,平衡逆向移动,有利于晶体析出。
(5)[Co(NH3)6]3+⇌Co3++6NH3K1;NH+4⇌NH3+H+K2判断K1<<(K2)6。(填“>”“<”或“=”)
(6)洗涤[Co(NH3)6]Cl3时可用 BDBD。(双选)
A.蒸馏水
B.冰水
C.无水乙醇
D.50%乙醇水溶液
测定产品中配体NH3与外界Cl-的物质的量之比。实验如下:
Ⅰ.蒸氨:取0.100g样品加入三颈烧瓶中,再加入足量NaOH溶液并充分加热,蒸出的气体全部通入V1mLc1mol/L的H2SO4中。
Ⅱ.滴定:用c2mol/LNaOH溶液滴定①中溶液,消耗V2mLNaOH溶液。
Ⅲ.沉淀:另取0.100g样品溶解,加入足量AgNO3溶液,过滤、洗涤、干燥、恒重,得到沉淀m3g。(MAgCl=143.5g/mol)
(7)滴定时选用的指示剂为 甲基橙或甲基红甲基橙或甲基红。
(8)测得产品中配体NH3与外界Cl-的物质的量比值为 2c1v1-c2v21000m3143.52c1v1-c2v21000m3143.5。(用含c1、V1等数据的代数式表示)若测得n(NH3):n(Cl-)比值偏小,可能的原因是 ACAC。(双选)
A.蒸氨结束时,未用蒸馏水洗涤冷凝管,并将洗涤液一并倒入H2SO4中
B.滴定步骤的NaOH溶液使用前敞口放置于空气中一段时间
C.滴定步骤中盛放NaOH溶液的滴定管未用NaOH溶液润洗
D.沉淀步骤中,沉淀未完全转移至漏斗中
K
w
c
(
O
H
-
)
K
w
c
(
O
H
-
)
NH
+
4
△
NH
+
4
△
NH
+
4
2
c
1
v
1
-
c
2
v
2
1000
m
3
143
.
5
2
c
1
v
1
-
c
2
v
2
1000
m
3
143
.
5
【考点】制备实验方案的设计;探究物质的组成或测量物质的含量.
【答案】恒压滴液漏斗;无水CaCl2或P2O5;冷凝回流;Ksp[Co(OH)2]=c(Co2+)c2(OH-)=6×10-15,c(OH-)=2.45×10-7mol/L,c(H+)==4.08×10-8mol/L,pH=-lgc(H+)=-lg4.08×10-8≈7.39,调节溶液的pH;调节溶液的pH,防止生成Co(OH)2沉淀;2[Co(NH3)6]2++H2O2+2 2[Co(NH3)6]3++2NH3+2H2O;[Co(NH3)6]Cl3⇌[Co(NH3)6]3++3Cl-,加入浓盐酸,c(Cl-)增大,平衡逆向移动,有利于晶体析出;<;BD;甲基橙或甲基红;;AC
K
w
c
(
O
H
-
)
NH
+
4
△
2
c
1
v
1
-
c
2
v
2
1000
m
3
143
.
5
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/16 9:0:1组卷:33引用:1难度:0.3
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
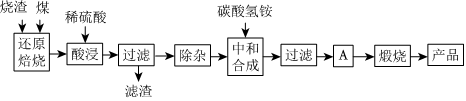
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
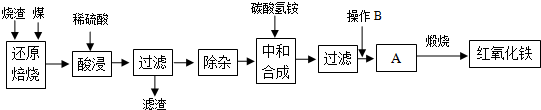
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
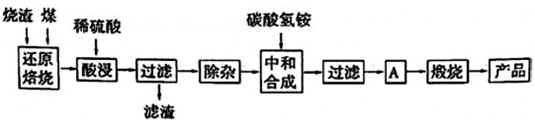
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


