获取能量变化有多种途径和方法,请根据所学完成下列各题。
(1)通过化学键的键能计算。已知:
| 化学键 | H-H | O-O | O-H |
| 键能(kJ•mol-1) | 436 | 496 | 463.4 |
-485.6
-485.6
kJ⋅mol-1。(2)通过物质所含能量计算。已知反应A+B=C+D中A、B、C、D所其存的能量依次可表示为EA、EB、EC、ED,该反应ΔH=
(EC+ED-EA-EB)kJ/mol
(EC+ED-EA-EB)kJ/mol
。(3)通过盖斯定律计算。已知在25℃、101kPa时,
2Na(s)+
1
2
2Na(s)+O2(g)═Na2O2(s) ΔH2=-511kJ⋅mol-1
写出Na2O2与Na这应生成Na2O的热化学方程式:
Na2O2(g)+2Na(g)=2Na2O(g)△H=-317kJ⋅mol-1
Na2O2(g)+2Na(g)=2Na2O(g)△H=-317kJ⋅mol-1
。(4)利用实验装置测量,测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol⋅L-1的盐酸,则还需加入
B
B
。A.50mL0.50mol⋅L-1NaOH溶液
B.50mL0.55mol⋅L-1NaOH溶液
C.1.0gNaOH固体
D.含0.025molNaOH的稀溶液
【答案】-485.6;(EC+ED-EA-EB)kJ/mol;Na2O2(g)+2Na(g)=2Na2O(g)△H=-317kJ⋅mol-1;B
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/4 8:0:9组卷:22引用:1难度:0.5
相似题
-
1.已知:
则乙苯催化脱氢制苯乙烯:化学键 C-H C-C C=C H-H 键能/kJ•mol‾1 412 348 612 436  的反应热为( )发布:2024/12/30 18:0:1组卷:19引用:2难度:0.9
的反应热为( )发布:2024/12/30 18:0:1组卷:19引用:2难度:0.9 -
2.德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。工业合成氨为解决世界的粮食问题做出了重要贡献,其原理为N2(g)+3H2(g)⇌2NH3(g)ΔH=-92.4kJ•mol-1。若已知H-H键的键能为436.0kJ•mol-1,N-H的键能为390.8kJ•mol-1,则N≡N的键能约为
kJ•mol-1。发布:2024/12/30 19:0:1组卷:0引用:3难度:0.7 -
3.氢气是一种清洁能源,也是一种重要的工业原料.
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)ΔH=-483.6kJ/mol
3H2 (g)+N2(g)⇌2NH3(g)ΔH=-92.4kJ/mol
计算断裂1mol N≡N键需要能量kJ,氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)氢气是工业合成氨的原料气,而氨气可用于合成硝酸.已知:N2(g)+O2(g)=2NO (g)ΔH=+180.8kJ/mol,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式.
(3)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2
和O2为原料制取过氧化氢的新工艺.原理如图2所示.请写出甲电极的电极反应式.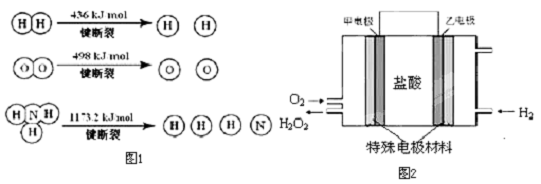 发布:2024/12/30 14:30:1组卷:9引用:3难度:0.1
发布:2024/12/30 14:30:1组卷:9引用:3难度:0.1


