能源、材料与生产生活和社会发展密切相关。
Ⅰ.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图: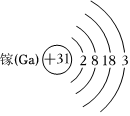
 。
。
(2)P、S、Ga电负性从大到小的顺序为 S>P>GaS>P>Ga。
(3)As元素的第一电离能 大于大于(填“大于”“小于”或“等于”)Se元素的第一电离能。
(4)写出原子序数最小的第Ⅷ族元素基态原子的核外电子排布式:1s22s22p63s23p63d64s21s22s22p63s23p63d64s2。
(5)写出3p轨道上只有2个未成对电子的元素的符号:SiSi、SS。
Ⅱ.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。


| 化学键 | H-H | N-H | N≡N |
| 键能/(kJ/mol) | 436 | 391 | 945 |
-93
-93
。【考点】元素电离能、电负性的含义及应用;原子核外电子排布.
【答案】 ;S>P>Ga;大于;1s22s22p63s23p63d64s2;Si;S;-93
;S>P>Ga;大于;1s22s22p63s23p63d64s2;Si;S;-93
 ;S>P>Ga;大于;1s22s22p63s23p63d64s2;Si;S;-93
;S>P>Ga;大于;1s22s22p63s23p63d64s2;Si;S;-93【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/22 0:0:2组卷:102引用:1难度:0.7
相似题
-
1.已知Al、Mg、Na为第三周期元素,其原子的第一至第四电离能如下表:
(1)则Al、Mg、Na的电负性从大到小的顺序为电离能/kJ•mol-1 I1 I2 I3 I4 X 578 1817 2745 11578 Y 738 1451 7733 10540 Z 496 4562 6912 9543 ;
(2)C、N、O、H是周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取杂化;
②CH4是含有键(填“极性”或“非极性”)的分子(填“极性”或“非极性”);
③NH3是一种易液化的气体,请简述其易液化的原因;
④H2O分子的VSEPR模型的空间构型为,H2O分子的空间构型为;
(3)K、Cr、Cu三种元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①K元素组成的单质的晶体堆积模型为(填代号);
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
②Cr元素在其化合物中最高化合价为;
③Cu2+离子的核外电子排布式为。发布:2025/1/5 8:0:1组卷:3引用:1难度:0.7 -
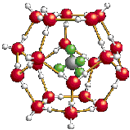 2.我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:
2.我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:
(1)C、N、O三种元素第一电离能由大到小的排列顺序是>>(填元素符号),H2O分子中O原子的杂化方式为.
(2)“可燃冰”晶体内部存在的作用力有.
(3)下列有关“可燃冰”的说法中,不正确的是.
A.“可燃冰”的存在说明甲烷易溶于水
B.“可燃冰”属于分子晶体,熔点较低
C.相同条件下,“可燃冰”的密度比冰的大
D.“可燃冰”只能在低温、高压环境下稳定存在
(4)晶体中平均每46个水分子构成8个笼,每个笼可容纳1个CH4分子或1个H2O分子,每8个笼中有6个容纳CH4分子,2个笼填充H2O分子,则“可燃冰”(天然气水合物)的平均组成可表示为.发布:2024/12/31 8:0:1组卷:23引用:1难度:0.3 -
3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为,其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为(用元素符号表示)。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)。
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+.该阴离子的电子式为,σ键和π键的数目之比为。其空间构型为。
(4)K3[Fe(CN)6]晶体中配离子的配位体为(用化学符号表示)发布:2025/1/5 8:0:1组卷:19引用:1难度:0.6


