某小组以盐酸、醋酸为例探究其酸性的强弱。按要求回答下列问题。
(1)取相同体积、相同浓度的盐酸和醋酸,分别测其pH和导电能力,对比分析,在下表填写空白。已知:pH=-lgc(H+)
| 酸 | 0.1mol/L盐酸 | 0.1mol/L醋酸 | |
| pH(25℃) | 1 | 3 | |
| 导电能力 | 强 | 弱 | |
| 分析与结论 | ①微观解释(写出溶质在溶液中的存在形式,填粒子的化学式) |
H+、Cl- H+、Cl-
|
CH3COOH、H+、CH3COO- CH3COOH、H+、CH3COO-
|
| ②电离方程式 |
HCl=H++Cl- HCl=H++Cl-
|
CH3COOH⇌H++CH3COO- CH3COOH⇌H++CH3COO-
|
|
1
0
-
3
×
1
0
-
3
0
.
1
-
1
0
-
3
1
0
-
3
×
1
0
-
3
0
.
1
-
1
0
-
3
(2)在上述醋酸溶液中加入如下表所示物质,分析其中粒子的变化等,填写空白。
| 加入少量的物质 | 醋酸电离平衡移动方向 填“→”“←”或“不移动” |
c ( H + ) c ( C H 3 COOH ) 填“变大”“变小”或“不变” |
| ①CH3COONa(s) |
← ←
|
变小 变小
|
| ②水 |
→ →
|
变大 变大
|
①反应前n(Mg)=
0.0025
0.0025
mol;充分反应后,剩余的n(Mg)=0.0005
0.0005
mol。②两锥形瓶内气体n随时间变化,对比分析后,在如下坐标中将示意曲线补充完整。


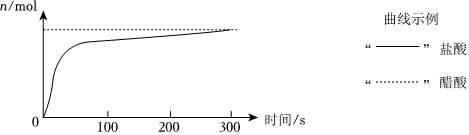
【考点】弱电解质的电离平衡;比较弱酸的相对强弱的实验.
【答案】H+、Cl-;CH3COOH、H+、CH3COO-;HCl=H++Cl-;CH3COOH⇌H++CH3COO-;;←;变小;→;变大;0.0025;0.0005;
1
0
-
3
×
1
0
-
3
0
.
1
-
1
0
-
3

【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/11 5:0:1组卷:13引用:1难度:0.5


