人类对原子结构的探索为科技发展带来了卓越贡献,门捷列夫发现的元素周期律也为研究物质性质,合成新的物质做出了重要的指导作用。
(1)(单选)工业焊接钢管时常用 13755Cs进行“无损探伤”,该原子 CC。
A.质子数是82
B.中子数是55
C.与 13155Cs互为同位素
D.摩尔质量是137
(2)(单选)下列变化中破坏共价键的是 CC。
A.冰融化
B.NaOH融化
C.HCl溶于水
D.干冰升华
五种短周期主族元素X、Y、Z、M和N,原子序数依次增大,相关信息如下表:
137
55
C
s
131
55
C
s
| 元素 | 相关信息 |
| X | 失去一个电子后成为质子 |
| Y | 气态氢化物的水溶液呈碱性,常做制冷剂 |
| Z | 原子核外最外层电子数是次外层的3倍 |
| M | 海水中含量最高的金属元素 |
| N | 单质为淡黄色固体,常存在于火山口附近 |
第二周期ⅥA族
第二周期ⅥA族
,M离子的结构示意图 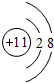
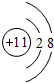
(4)写出元素Y的氢化物的电子式
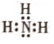
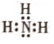
(5)5种元素原子半径由大到小的顺序为
Na>S>N>O>H
Na>S>N>O>H
。(用对应的元素符号表示)(6)(双选)下列选项中能证明Y和Z元素非金属性强弱的有
BD
BD
。A.最高价氧化物对应水化物的酸性:Z>Y
B.与氢气化合物放出的热量:Z>Y
C.气态氢化物的沸点:Z>Y
D.单质的氧化性:Z>Y
(7)用一个化学方程式表示Z和N元素的非金属性强弱
2H2S+O2=2H2O+2S↓
2H2S+O2=2H2O+2S↓
。(8)X元素有3种核素,分别是:氕,丰度为99.98%;氘,丰度为0.016%;氚,丰度为0.004%,则X元素的相对原子质量计算表达式为:
m0=m1×99.98%+m2×0.016%+m3×0.004%
m0=m1×99.98%+m2×0.016%+m3×0.004%
(氕、氘、氚原子的质量用m1、m2、m3表示,12C原子质量用m0表示)。【答案】C;C;第二周期ⅥA族;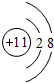 ;
;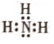 ;Na>S>N>O>H;BD;2H2S+O2=2H2O+2S↓;m0=m1×99.98%+m2×0.016%+m3×0.004%
;Na>S>N>O>H;BD;2H2S+O2=2H2O+2S↓;m0=m1×99.98%+m2×0.016%+m3×0.004%
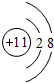 ;
;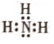 ;Na>S>N>O>H;BD;2H2S+O2=2H2O+2S↓;m0=m1×99.98%+m2×0.016%+m3×0.004%
;Na>S>N>O>H;BD;2H2S+O2=2H2O+2S↓;m0=m1×99.98%+m2×0.016%+m3×0.004%【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/3 8:0:9组卷:64引用:1难度:0.6
相似题
-
1.X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2,五种元素中M的电负性最小,N的最高价含氧酸酸性最强。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:47引用:1难度:0.5 -
2.A、B、C、D、E为原子序数依次增大的五种短周期元素;A是宇宙中最丰富的元素且与E同主族;B位于元素周期表ⅣA族;C在元素周期表中与B、D相邻;D基态原子的s轨道与p轨道的电子总数相等且p轨道有2个未成对的电子;E是短周期中原子半径最大的元素;F原子核外电子数为29.回答下列问题:
(1)F基态原子的核外电子排布式为。
(2)A、B、C、D、E五种元素中,电负性最小的元素为(填元素符号,下同),第一电离能最大的元素为;A3D+的立体构型为。
(3)A、B可形成多种化合物,其中相对分子质量为28的分子,其中心原子的杂化方式为,该分子中σ键和π键的数目之比为。
(4)化合物BD2和E2D2的晶体类型分别为、。
(5)F单质为面心立方晶体,若F的相对原子质量为M,阿伏加德罗常数为NA,晶胞边长为a cm,则晶体F的密度ρ=g•cm-3。发布:2025/1/18 8:0:1组卷:28引用:2难度:0.3 -
3.已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的.则:
(1)A元素为C元素为E元素为
(2)由上述元素形成的10电子分子有、.
(3)由B和D以质量比为3:8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为.
(4)G单质与E的最高价氧化物的水化物反应的离子方程式为
(5)B、C、D形成的气态氢化物中,较稳定的是
(6)由A、C、G形成的离子化合物的化学式是.发布:2024/12/30 18:30:1组卷:7引用:3难度:0.5


