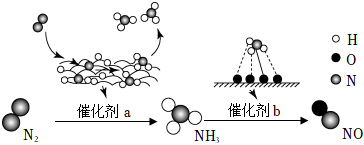
 氨是人科学技术发展史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
氨是人科学技术发展史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
小于
小于
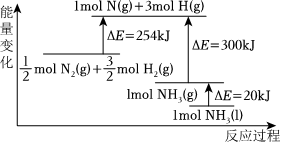
工业固氮(填“大于”或“小于”)。(2)N2(g)与H2(g)反应的能量变化如图所示,则N2(g)与H2(g)反应制备NH3(g)的热化学方程式为:
N2(g)+3H2(g)⇌2NH3(l)ΔH=-132kJ/mol
N2(g)+3H2(g)⇌2NH3(l)ΔH=-132kJ/mol
。(3)有关工业固氮的说法正确的是
B
B
(选填序号)。A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强大越好
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
Fe
Fe
(填化学式)。(5)对于合成氨反应N2(g)+3H2(g)⇌2NH3(g)ΔH<0,下列研究结果和示意图相符的是
C
C
。| 选项 | A | B | C | D |
| 研究结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 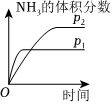 |
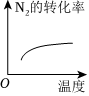 |
 |
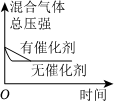 |
【答案】小于;N2(g)+3H2(g)⇌2NH3(l)ΔH=-132kJ/mol;B;Fe;C
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/5 16:0:2组卷:9引用:2难度:0.5