现有平板电视显示屏工厂生产过程中丢弃废玻璃粉末(含SiO2、Fe2O3、CeO2等物质),某课题组以此粉末为原料回收铈和硫酸亚铁晶体,设计实验流程如下:
资料1:CeO2是一种金属氧化物,化学性质稳定,与稀硫酸不反应。在H2O2存在的条件下,两种物质能反应。
资料2:FeSO4容易被空气中的O2氧化。
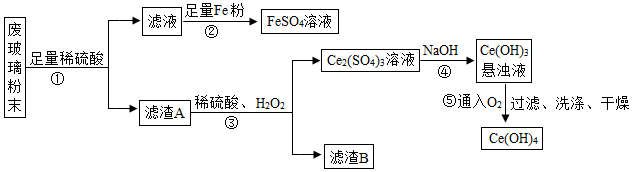
(1)写出①反应的化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2OFe2O3+3H2SO4═Fe2(SO4)3+3H2O,该反应类型为复分解反应复分解反应,为提高①中的反应效率,可采用的具体措施有加热(或粉碎、搅拌、提高硫酸的浓度等)加热(或粉碎、搅拌、提高硫酸的浓度等)。(写一种即可)
(2)将②中所得FeSO4溶液在氮气环境中蒸发浓缩、冷却结晶冷却结晶、过滤,得到FeSO4晶体,其中氮气的作用是作保护气(或避免FeSO4被空气中的O2氧化作保护气(或避免FeSO4被空气中的O2氧化。
(3)请补充完整③反应的化学方程式:2CeO2+3H2SO4+H2O2═Ce2(SO4)3+4H2O4H2O+O2↑,滤渣B的主要成分是SiO2SiO2。
(4)生产过程中可循环利用的物质是O2O2。
(5)Ce(OH)4中的Ce元素化合价为+4+4价。
【答案】Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;复分解反应;加热(或粉碎、搅拌、提高硫酸的浓度等);冷却结晶;作保护气(或避免FeSO4被空气中的O2氧化;4H2O;SiO2;O2;+4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/9 8:0:8组卷:73引用:3难度:0.4
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
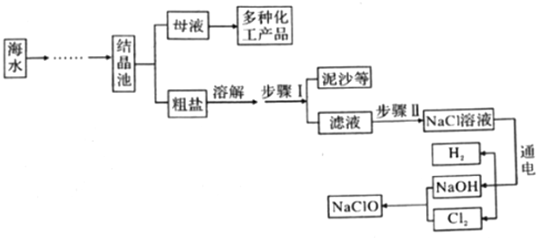
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
2.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7 -
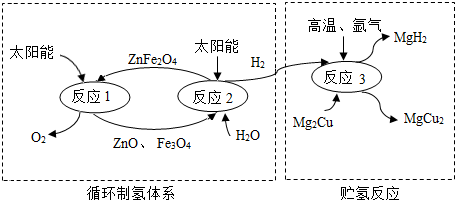 3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5


