某化学兴趣小组据用金属钠和空气制备纯度较高的Na2O2(N2不与金属钠反应),可利用的装置如图,回答下列问题:
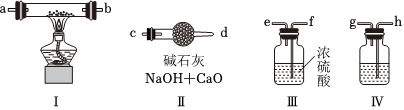
(1)装置Ⅳ中盛放的药品是 NaOH溶液NaOH溶液,若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为 2Na2O2+2CO2=2Na2CO3+O22Na2O2+2CO2=2Na2CO3+O2。
(2)若规定气体的气流方向从左到右,则各仪器接口的标号字母(a、b••••••)顺序应为:空气进入h,gg接 ff,ee接 aa,bb接 cc,d。
(3)装置Ⅱ的作用是 防止空气中的水蒸气和二氧化碳进入装置Ⅰ防止空气中的水蒸气和二氧化碳进入装置Ⅰ。
(4)该兴趣小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①酚酞溶液变红的原因是 过氧化钠与水反应生成氢氧化钠过氧化钠与水反应生成氢氧化钠,红色褪去的可能原因是 反应生成的H2O2具有漂白作用反应生成的H2O2具有漂白作用。设计一个简单的实验方案证明你的猜想 取褪色后溶液于试管中,滴加NaOH溶液,观察溶液是否变红取褪色后溶液于试管中,滴加NaOH溶液,观察溶液是否变红。
②加入MnO2反应的化学方程式为 2H2O2 MnO2 2H2O+O2↑2H2O2 MnO2 2H2O+O2↑。
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,这兴趣小组的同学们又设计了如图的实验装置,分别进行了甲、乙两次实验:
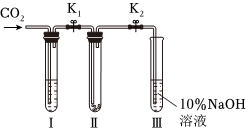
实验甲:干燥的二氧化碳和过氧化钠的反应,在干燥的试管口中装入Na2O2,在通入CO2之前,关闭K1和K2,在试管Ⅰ内装入试剂X后,打开K1和K2通入CO2几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲。观察到木条复燃,且Ⅱ中的淡黄色变为白色。
回答下列问题:
(5)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是 防止Na2O2受潮防止Na2O2受潮。
(6)在实验甲中,试剂X是 浓硫酸浓硫酸;在实验乙中,试剂Y是 饱和NaHCO3溶液或水饱和NaHCO3溶液或水。
(7)根据上述两个实验现象,得到的结论是:二氧化碳只有水存在时才能和过氧化钠反应二氧化碳只有水存在时才能和过氧化钠反应。
(8)为了确保实验现象的准确性,制备CO2所用的反应物最好选用 BEBE(不定项选择)。
A.大理石
B.小苏打
C.烧碱
D.盐酸
E.稀硫酸
F.稀硝酸
M
n
O
2
M
n
O
2
【答案】NaOH溶液;2Na2O2+2CO2=2Na2CO3+O2;g;f;e;a;b;c;防止空气中的水蒸气和二氧化碳进入装置Ⅰ;过氧化钠与水反应生成氢氧化钠;反应生成的H2O2具有漂白作用;取褪色后溶液于试管中,滴加NaOH溶液,观察溶液是否变红;2H2O2 2H2O+O2↑;防止Na2O2受潮;浓硫酸;饱和NaHCO3溶液或水;二氧化碳只有水存在时才能和过氧化钠反应;BE
M
n
O
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/11 8:0:9组卷:35引用:1难度:0.5
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
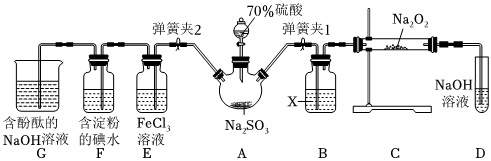
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
 2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
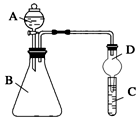
3.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色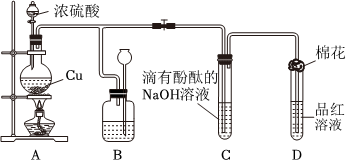 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7


