四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25℃,沸点为136.4℃。在700℃左右,将氯气通过二氧化钛和炭粉的混合物可生成四氯化钛和一种有毒气体。如图是实验室制备TiCl4的部分装置(加热和夹持仪器已略去):
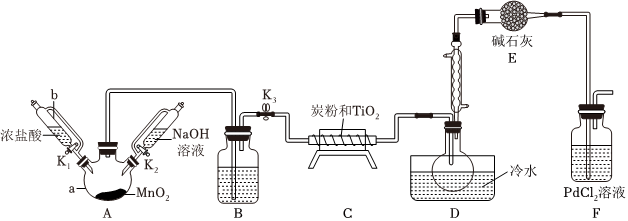
(1)仪器b的名称是 恒压滴液漏斗恒压滴液漏斗,C中反应的化学方程式为 TiO2+2Cl2+2C 700℃ TiCl4+2COTiO2+2Cl2+2C 700℃ TiCl4+2CO。
(2)装置E中碱石灰的作用是 防止装置F中水蒸气进入,影响产品纯度;吸收尾气氯气,防止污染空气防止装置F中水蒸气进入,影响产品纯度;吸收尾气氯气,防止污染空气。装置F中生成了金属单质和两种酸性气体,写出其反应的化学方程式为 PbCl2+CO+H2O=Pb↓+2HCl+CO2PbCl2+CO+H2O=Pb↓+2HCl+CO2。
(3)反应结束拆除装置前,除去A中残留氯气的操作是 关闭K1、K3,打开K2,滴加氢氧化钠溶液,吸收残留氯气关闭K1、K3,打开K2,滴加氢氧化钠溶液,吸收残留氯气。
(4)利用如图所示装置测定所得TiCl4的纯度:取0.3g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴入3滴0.1mol/LK2CrO4溶液作指示剂。用0.2mol/LAgNO3标准溶液滴定至终点,消耗25.00mLAgNO3标准溶液。已知:Ag2CrO4呈砖红色。
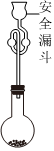
①安全漏斗在本实验中的作用除加水外,还有 液封,吸收挥发的HCl,避免HCl的损失液封,吸收挥发的HCl,避免HCl的损失。
②达到滴定终点时的现象为 当加入最后半滴AgNO3标准溶液时,溶液恰好出现砖红色沉淀,且半分钟内不消失当加入最后半滴AgNO3标准溶液时,溶液恰好出现砖红色沉淀,且半分钟内不消失。
③产品中TiCl4的纯度为 79.2%79.2%(保留一位小数)。
700
℃
700
℃
【考点】制备实验方案的设计.
【答案】恒压滴液漏斗;TiO2+2Cl2+2C TiCl4+2CO;防止装置F中水蒸气进入,影响产品纯度;吸收尾气氯气,防止污染空气;PbCl2+CO+H2O=Pb↓+2HCl+CO2;关闭K1、K3,打开K2,滴加氢氧化钠溶液,吸收残留氯气;液封,吸收挥发的HCl,避免HCl的损失;当加入最后半滴AgNO3标准溶液时,溶液恰好出现砖红色沉淀,且半分钟内不消失;79.2%
700
℃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/23 1:0:2组卷:34引用:2难度:0.3
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
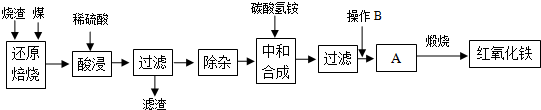
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
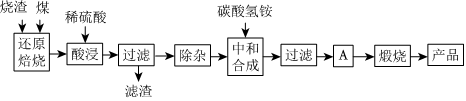
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
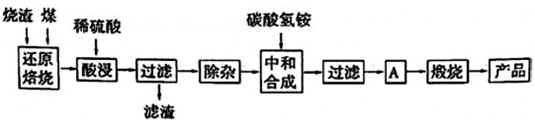
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


