完成下列问题
(1)25℃时,物质的量浓度均为0.1mol⋅L-1的几种盐溶液的pH如下表所示。
| 序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 溶液 | NH4Cl溶液 | CH3COONH4溶液 | NaHCO3溶液 | NaClO溶液 |
| pH | 5 | 7 | 8.4 | 10.3 |
ClO-+H2O⇌HClO+OH-
ClO-+H2O⇌HClO+OH-
(用离子方程式表示)。②溶液Ⅰ中离子浓度由大到小的关系为
c(Cl-)>c()>c(H+)>c(OH-)
NH
+
4
c(Cl-)>c()>c(H+)>c(OH-)
(用离子浓度符号表示)。NH
+
4
③溶液Ⅱ中,Ka(CH3COOH)
=
=
(填“>”或“<”或“=”)Kb(NH3⋅H2O)。(2)几种离子开始沉淀时的pH如下表所示。
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 4.4 | 10.4 |
Cu2+
Cu2+
(填离子符号)最先沉淀。②25℃时,若要使0.2mol⋅L-1硫酸铜溶液中的铜离子浓度降至原来的千分之一则应向溶液中加入氢氧化钠溶液。使溶液的pH为
6
6
{已知Ksp[Cu(OH)2]=2×10-20}。(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液是中性,则混合前c(NaOH)
<
<
c(CH3COOH)(填“>”或“<”或“=”)。(4)常温下,将两种一元酸HX和HY分别和NaOH溶液等体积混合,实验数据如下。下列说法正确的是
D
D
。| 组别 | 混合前 | 混合后 | |
| 甲 | c(HX)=0.1mol⋅L-1 | c(NaOH)=0.1mol⋅L-1 | pH=9 |
| 乙 | c(HY)=0.1mol⋅L-1 | c(NaOH)=0.1mol⋅L-1 | pH=7 |
B.HX溶液的pH<1
C.甲的混合液中c(X-)=c(Na+)
D.乙的混合液中c(Na+)=c(Y-)
【答案】ClO-+H2O⇌HClO+OH-;c(Cl-)>c()>c(H+)>c(OH-);=;Cu2+;6;<;D
NH
+
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/5 1:0:1组卷:15引用:2难度:0.6
相似题
-
1.常温下,在体积均为20mL、浓度均为0.1mol/L的HX溶液、HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示。下列推断正确的是( )
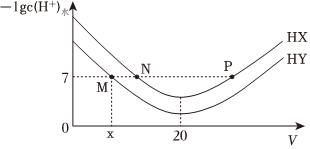 发布:2024/12/15 2:30:7组卷:71引用:4难度:0.6
发布:2024/12/15 2:30:7组卷:71引用:4难度:0.6 -
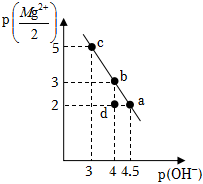 2.25℃时,向10mL0.05mol•L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p()之间的变化曲线如图所示[已知:Kb(NH3•H2O)=1.0×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确的是( )Mg2+2发布:2024/12/30 4:0:1组卷:23引用:2难度:0.5
2.25℃时,向10mL0.05mol•L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p()之间的变化曲线如图所示[已知:Kb(NH3•H2O)=1.0×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确的是( )Mg2+2发布:2024/12/30 4:0:1组卷:23引用:2难度:0.5 -
3.下列说法正确的是( )
发布:2025/1/1 8:0:2组卷:0引用:1难度:0.7


