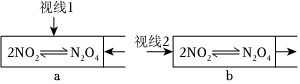
 某课外活动小组为了探究外界条件对化学平衡的影响,做了如图实验:
某课外活动小组为了探究外界条件对化学平衡的影响,做了如图实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:I=kc⋅L(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入10mLNO2气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是 颜色先变深后变浅(比原色深)颜色先变深后变浅(比原色深);
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是 颜色变深颜色变深。
(2)探究浓度对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol⋅L-1FeCl3溶液(接近无色)和0.01mol⋅L-1KSCN溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该 不变不变(填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中[AlF6]3-、银氨溶液中1mol[Ag(NH3)2]+、[CuCl4]2-、[FeCl4]-等。因此预测红色应该 变浅变浅(填“变深”“变浅”或“不变”),理由:所加KCl电离出的Cl-与Fe3+结合成[FeCl4]-,Fe3+浓度减少使平衡逆向移动,颜色变浅所加KCl电离出的Cl-与Fe3+结合成[FeCl4]-,Fe3+浓度减少使平衡逆向移动,颜色变浅。
[
F
e
C
l
4
]
-
[
F
e
C
l
4
]
-
【考点】化学平衡的影响因素.
【答案】颜色先变深后变浅(比原色深);颜色变深;不变;变浅;所加KCl电离出的Cl-与Fe3+结合成,Fe3+浓度减少使平衡逆向移动,颜色变浅
[
F
e
C
l
4
]
-
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/11 9:0:2组卷:17引用:4难度:0.5
相似题
-
1.升高温度,下列数据不一定增大的是( )
发布:2025/1/6 6:0:5组卷:31引用:4难度:0.7 -
2.催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生以下两个平衡反应。下列有关说法不正确的是( )
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2=+41.2kJ•mol-1发布:2025/1/6 6:0:5组卷:90引用:3难度:0.5 -
3.现代工业将煤汽化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的用途.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用水煤气来合成甲醇CO(g)+2H2(g)⇌CH3OH(g).
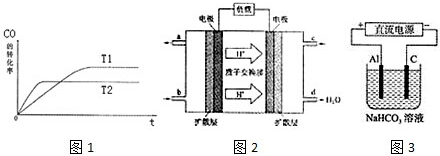
(1)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①T1和T2温度下的平衡常数大小关系是K1K2(填“>”、“<”或“=”).
②以下有关说法正确的是
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
d.某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%
(2)已知在常温常压下①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkJ•mol-1③H2O(g)=H2O(1)△H=-ckJ•mol-1
则:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=kJ•mol-1
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池正极的电极反应式为.
②工作一段时间后,当6.4g甲醇完全反应生成CO2时,有个电子发生转移.
(4)以上述电池做电源,用图3所示装置,在实验室中模拟铝制品面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是、(用相关的电极反应式和离子方程式表示)发布:2024/12/30 14:0:1组卷:26引用:3难度:0.5


