金属钛密度小、强度高、抗腐蚀性能好,是应用广泛的金属。含钛的矿石主要有金红石和钛铁矿。
(1)基态Ti原子的价层电子排布式为 3d24s23d24s2,含有未成对电子 22个,Ti元素在周期表中的位置是 第四周期第ⅣB族第四周期第ⅣB族。
(2)将1molTiCl3•4H2O溶于水,加入足量AgNO3溶液,得到1molAgCl沉淀,已知Ti3+的配位数为6,TiCl3•4H2O的化学式用配合物的形式表示为 [Ti(H2O)4Cl2]Cl[Ti(H2O)4Cl2]Cl。
金红石的主要成分是钛的一种氧化物,该氧化物的晶胞边长分别为apm,bpm,cpm。结构如图1所示。
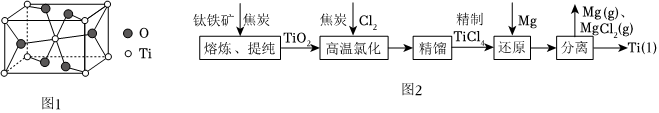
(3)由图可知该氧化物的化学式是 TiO2TiO2,Ti填充在O构成的 CC空隙中。
A.三角形
B.四面体
C.八面体
(4)该氧化物的熔点为1850℃,其晶体类型最不可能是 CC。
A.共价晶体
B.离子晶体
C.分子晶体
(5)已知mg该氧化物晶体体积为Vcm3,则阿伏加德罗常数NA=1.6×1032mabcmol-11.6×1032mabcmol-1。
以钛铁矿为原料,用镁还原法冶炼金属钛的工艺流程如图2所示。
(6)高温氯化时除TiCl4外还得到一种可燃性气体,写出反应的方程式 TiO2+2C+2Cl2 高温 TiCl4+2COTiO2+2C+2Cl2 高温 TiCl4+2CO。
(7)结合工艺流程和熔沸点数据,“分离”时所需控制的最低温度应为 16681668℃。
1
.
6
×
1
0
32
mabc
1
.
6
×
1
0
32
mabc
高温
高温
| Ti | Mg | MgCl2 | |
| 熔点/℃ | 1668 | 651 | 714 |
| 沸点/℃ | 3287 | 1107 | 1412 |
Mg2+所带电荷小于Ti4+所带电荷,Ti的金属键大于Mg的金属键
Mg2+所带电荷小于Ti4+所带电荷,Ti的金属键大于Mg的金属键
。【答案】3d24s2;2;第四周期第ⅣB族;[Ti(H2O)4Cl2]Cl;TiO2;C;C;mol-1;TiO2+2C+2Cl2 TiCl4+2CO;1668;Mg2+所带电荷小于Ti4+所带电荷,Ti的金属键大于Mg的金属键
1
.
6
×
1
0
32
mabc
高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/17 4:0:8组卷:31引用:1难度:0.5
相似题
-
 1.铁及其化合物在生产生活及科学研究方面应用非常广泛。
1.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
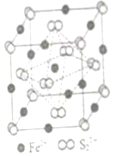
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7 -
 2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为,F的价层电子排布式为.
(2)B、C、D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是.
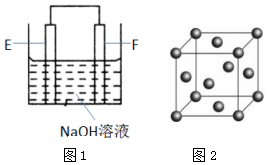
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)发布:2025/1/18 8:0:1组卷:14引用:2难度:0.5 -
 3.碳及其化合物有着重要用途。回答下列问题:
3.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
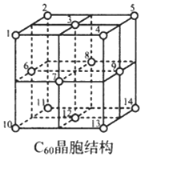
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为Å。发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4


