为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是 ②③②③。
①浓H2SO4稀释
②酸碱中和反应
③H2在Cl2中燃烧
④固体NaOH溶于水
⑤液态水变成水蒸气
⑥碳高温条件下还原CO2
(2)沼气是一种能源,它的主要成分是CH4,常温下,0.5molCH4完全燃烧生成CO2(g)和液态水时,放出445kJ热量,则热化学方程式为 CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH═-890kJ/molCH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH═-890kJ/mol。
(3)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为akJ•mol-1,写出H2S的燃烧热的热化学方程式 H2S(g)+32O2(g)═SO2(g)+H2O(l)ΔH═-akJ•mol-1H2S(g)+32O2(g)═SO2(g)+H2O(l)ΔH═-akJ•mol-1。
(4)已知:12N2(g)+32H2(g)═N(g)+3H(g)ΔH1═+akJ•mol-1
N(g)+3H(g)═NH3(g)ΔH2═-bkJ•mol-1
NH3(g)═NH3(l)ΔH3═-ckJ•mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式 N2(g)+3H2(g)⇌2NH3(l)ΔH═(+2a-2b-2c)kJ•mol-1N2(g)+3H2(g)⇌2NH3(l)ΔH═(+2a-2b-2c)kJ•mol-1。
(5)已知:①HF(aq)+OH-(aq)═F-(aq)+H2O(l)ΔH═-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)ΔH═-57.3kJ•mol-1
试写出HF电离的热化学方程式 HF(aq)⇌F-(aq)+H+(aq)ΔH═-10.4kJ•mol-1HF(aq)⇌F-(aq)+H+(aq)ΔH═-10.4kJ•mol-1。
(6)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ•mol-1,S-F键能为330kJ•mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式 S(s)+3F2(g)═SF6(g)ΔH═-1220kJ•mol-1S(s)+3F2(g)═SF6(g)ΔH═-1220kJ•mol-1。
3
2
3
2
1
2
3
2
【答案】②③;CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH═-890kJ/mol;H2S(g)+O2(g)═SO2(g)+H2O(l)ΔH═-akJ•mol-1;N2(g)+3H2(g)⇌2NH3(l)ΔH═(+2a-2b-2c)kJ•mol-1;HF(aq)⇌F-(aq)+H+(aq)ΔH═-10.4kJ•mol-1;S(s)+3F2(g)═SF6(g)ΔH═-1220kJ•mol-1
3
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/24 1:0:8组卷:7引用:2难度:0.7
相似题
-
1.肼(N2H4)可作为发射火箭的燃料。已知1g液态肼(N2H4)气体在空气中燃烧生成氮气和水蒸气,放出16.7kJ的热量,该反应的热化学方程式是( )
发布:2024/12/30 3:0:4组卷:121引用:9难度:0.6 -
2.氢在地球上主要以化合态的形式存在,是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,属于二次能源.工业上生产氢的方式很多,常见的有水电解制氢,煤炭气化制氢,重油及天然气水蒸气催化制氢等.氢气是一种理想的绿色能源,如图1为氢能产生和利用的途径:
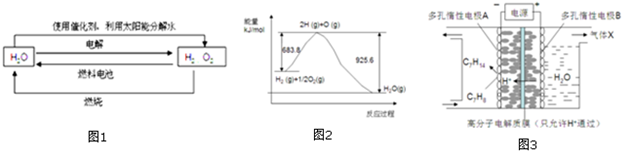
(1)图1的四个过程中能量转化形式有
A.2种 B.3种 C.4种 D.4种以上
(2)电解过程要消耗大量的电能,而使用微生物作催化剂在阳光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通电2H2(g)+O2(g)△H2光照催化剂
以上反应的△H1△H2(选填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依据图2能量变化写出氢气燃烧生产液态水的热化学方程式
(4)氢能利用需要选择合适的储氢材料.
①NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
②镧镍合金在一定条件下可吸收氢气生产氢化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)释放出气态氢,根据平衡移动的原理,可改变的条件之一是
③一定条件下,如图3所示装置可实现有机物的电化学储氢,使C7H8转化为C7H14,则电解过程中产生的气体X 为,电极A上发生的电极反应式为.发布:2024/12/17 8:0:2组卷:38引用:1难度:0.5 -
3.在298K、1.01×105Pa下,将0.5mol CO2通入750mL 1mol•L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1mol CO2通入1L 2mol•L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
发布:2024/12/30 4:0:1组卷:143引用:5难度:0.7


