化学研究的对象是我们身边的物质
一、氧气
通过“红磷燃烧”的实验我们测定了空气中氧气的含量,“暖宝宝贴”是冬天常见的取暖小物件,其主要成分为铁粉、木炭、食盐,用“暖宝宝贴”也可以测定空气中氧气的含量,反应的原理就是铁生锈消耗空气中氧气和水并放出热量。实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为250mL)中水的体积为45mL(铁粉锈蚀消耗的水忽略不计)。回答问题:
(1)成分中的食盐的作用是 加快铁的锈蚀加快铁的锈蚀。
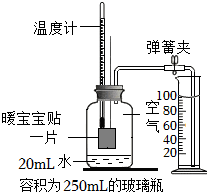
(2)和红磷燃烧相比,该实验的优点有 实验一直处于密闭状态,误差较小实验一直处于密闭状态,误差较小。
(3)本次实验中测得空气中氧气的体积分数约为 19.6%19.6%。(保留一位小数)
(4)若测得空气中氧气含量偏低,可能原因是 加入的药品较少,氧气没有被完全消耗加入的药品较少,氧气没有被完全消耗。
二、双氧水
小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液—“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,做了如下实验。
[实验一]探究该双氧水是否失效。
(1)实验过程:
①在试管中加入5mL“双氧水”,把带火星的木条伸入试管中,发现木条未复燃:
②给上述试管加热,液体中有较多气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 减少水的蒸发减少水的蒸发。
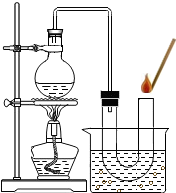
(2)实验结论:在加热的条件下过氧化氢可以分解产生氧气在加热的条件下过氧化氢可以分解产生氧气。
[实验二]探究二氧化锰在双氧水的分解反应中起催化作用,在反应前后质量是否发生改变。
(3)写出该反应的符号表达式 H2O2MnO2H2O+O2H2O2MnO2H2O+O2。
(4)实验步骤:
①称取一定质量的二氧化锰;
②将二氧化锰装入大试管中并加入5.0mL“双氧水”;
③待反应结束后,将大试管里的固体物质进行过滤、洗涤、烘干、称量:
④得出结论。
(5)做完此实验后,小方认为要证明二氧化锰的催化作用,还需要再补充一个探究实验:探究通过实验确认它在化学反应前后 化学性质化学性质不变。
[实验反思]依据实验一、实验二,影响化学反应速率的因素可能有 温度、催化剂温度、催化剂等。
三、碳酸氢铵
如图是碳酸氢铵受热分解的改进装置,
[查阅资料]氨气能使湿润的红色石蕊试纸变蓝。
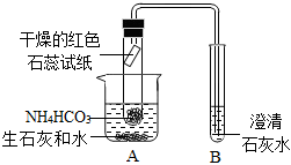
回答下列问题:
(1)按要求装配好仪器,实验前首先要检查 装置的气密性装置的气密性。
(2)在烧杯中先加入水,然后向其中加入生石灰,烧杯A中生石灰(主要成分为氧化钙)能与水反应生成氢氧化钙,实现了反应所需的温度条件,说明该反应 吸热吸热(填“吸热”或“放热”);写出碳酸氢铵受热分解的符号表达式 NH4HCO3△NH3+H2O+CO2NH4HCO3△NH3+H2O+CO2。
(3)根据现象:干燥的红色石蕊试纸变蓝干燥的红色石蕊试纸变蓝,证明实验后生成了水和氨气。
(4)写出装置B中发生反应的符号表达式 CO2+Ca(OH)2→CaCO3+H2OCO2+Ca(OH)2→CaCO3+H2O。
M
n
O
2
M
n
O
2
△
△
【答案】加快铁的锈蚀;实验一直处于密闭状态,误差较小;19.6%;加入的药品较少,氧气没有被完全消耗;减少水的蒸发;在加热的条件下过氧化氢可以分解产生氧气;H2O2H2O+O2;化学性质;温度、催化剂;装置的气密性;吸热;NH4HCO3NH3+H2O+CO2;干燥的红色石蕊试纸变蓝;CO2+Ca(OH)2→CaCO3+H2O
M
n
O
2
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/22 5:0:8组卷:31引用:1难度:0.5
相似题
-
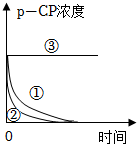 1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
(1)请结合上述介绍将表中空格补充完整。
(2)实验测得p-CP的浓度随时间变化的关系如图所示,根据实验①、②图像可得出结论:实验编号 实验目的 温度/℃
pH浓度/(mg•L﹣1) H2O2 Fe2+ ① 为②③提供参照 25 3 204 16.8 ② 探究温度对降解反应速率的影响
3 204 16.8 ③ 探究溶液pH对降解反应速率的影响 25 10 204 16.8 。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据本题信息,将样品从反应器中取出后应立即将其放入某药品中,反应会迅速停止,该药品可能是。
A盐酸溶液 B氢氧化钠溶液 C稀硫酸溶液 D碳酸钠溶液发布:2024/11/25 8:0:2组卷:3引用:0难度:0.3 -
2.据图1装置图回答问题
(1)甲同学用氯酸钾和二氧化锰共热制备和收集氧气,他应选用的气体发生装置是(填序号).他用装置C来收集的原因是,当看到导管口的时他才开始收集氧气.
(2)该同学用如图2所示的方法进行气密性检查,如果装置不漏气,可以看到,将手松开一段时间后(导管仍插入水中),可以看到导管中会形成一段水柱.
(3)因为氧气的密度比空气的稍大,所以还可以选用(填序号)来收集氧气,其验满的方法是.
(4)老师提醒可以用F(万能瓶)来收集气体,则甲同学应将发生装置的导管与F的导管(选填a或b)相连接.
(5)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,这位同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的二氧化锰(MnO2)分解放出O2;
猜想Ⅱ:反应生成的锰酸钾(K2MnO4)分解放出O2;
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想(选填Ⅰ或Ⅱ)错误;
第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是.
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?.
(6)丙同学选择用双氧水和二氧化锰混合来制氧气,则他应选用的气体发生装置是(填序号).以下是他探究影响该反应速率因素的相关实验数据.
通过以上实验数据的分析,可知,过氧化氢分解制氧气的化学反应速率与实验
序号H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2用量/g 收集到的
氧气体积/mL反应所需的
时间/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有关;发生装置中的(填仪器名称)也可以帮助控制反应的速率.发布:2024/12/18 8:0:1组卷:12引用:2难度:0.5 -
3.下列探究影响化学反应速率因素的实验中,实验方案正确的是( )
选项 影响因素 实验方案 A 接触面积 将1g块状石灰石和20mL10%的稀盐酸、1g粉末状石灰石与20mL10%的稀硫酸混合,比较产生气泡的快慢 B 催化剂的种类 将0.5g二氧化锰、1g氧化铁分别与10mL6%的过氧化氢溶液混合,比较产生气泡的快慢 C 反应物的种类 分别将木炭在空气中、氧气中燃烧,比较反应的剧烈程度 D 反应物的性质 分别用酒精灯加热表面积相同的镁片和铁片,比较在空气中能否被点燃 发布:2024/12/25 13:0:1组卷:114引用:4难度:0.7


