某化学兴趣小组为比较稀盐酸和稀CH3COOH溶液酸性的相对强弱,设计了如下实验方案,实验装置如图所示(夹持仪器已略去).
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积.
请回答下列问题:
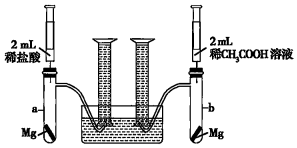
(1)在上述实验方案中有一明显缺陷,该缺陷是 没有说明两种酸的物质的量浓度没有说明两种酸的物质的量浓度。
(2)在缺陷已经得到改正的前提下,反应起始时,aa(填“a”或“b”)中产生氢气的速率较快;最终产生氢气的体积 相等相等。(填“相等”或“不相等”)
(3)最终发现,实验中产生氢气的体积比理论值大,可能原因是 镁与酸反应放热,导致过量的镁与水反应产生部分氢气镁与酸反应放热,导致过量的镁与水反应产生部分氢气。
(4)通过比较起始反应速率可得出的结论是 等物质的量浓度的稀盐酸的酸性强于稀醋酸溶液的酸性等物质的量浓度的稀盐酸的酸性强于稀醋酸溶液的酸性。
【考点】比较弱酸的相对强弱的实验.
【答案】没有说明两种酸的物质的量浓度;a;相等;镁与酸反应放热,导致过量的镁与水反应产生部分氢气;等物质的量浓度的稀盐酸的酸性强于稀醋酸溶液的酸性
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 0:0:1组卷:9引用:3难度:0.5
相似题
-
1.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和
(2)为标定某醋酸溶液的准确浓度,用0.200 0mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,使用滴定管时第一步操作的是,实验中使用的锥形瓶和碱式滴定管分别只用水洗涤则所测得的醋酸浓度分别会(填“偏大”、“偏小”或“不变”).
若几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为实验序号 1 2 3 4 消耗NaOH溶液的体积(mL) 20.05 20.00 18.80 19.95 .
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:醋酸浓度(mol•L-1) 0.001 0 0.010 0 0.020 0 0.100 0 0.200 0 pH 3.88 3.38 3.23 2.88 2.73 ,写出醋酸电离的方程式.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将(填“增大”“减小”或“不变”).
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:.发布:2024/11/18 8:0:1组卷:27引用:1难度:0.5 -
2.下列事实能说明碳酸的酸性比乙酸弱的是( )
发布:2024/12/30 7:30:1组卷:152引用:8难度:0.9 -
3.SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。仪器选择、连接顺序正确的是(SO2发生装置已略去,且通入的SO2纯净)( )
 发布:2024/12/30 4:30:1组卷:78引用:2难度:0.6
发布:2024/12/30 4:30:1组卷:78引用:2难度:0.6


