当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
专题复习
温故知新
人教版(2019)
苏教版(2019)
浏览次数:11
更新:2025年06月26日
|
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2283
更新:2025年06月03日
|
1391.下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是( )
发布:2024/12/30 12:0:1组卷:36引用:3难度:0.91392.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
发布:2024/12/30 12:0:1组卷:50引用:6难度:0.91393.根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的,其外围电子排布图是14。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是,价层电子排布式,在元素周期表中的位置是。
(3)C元素基态原子的电子排布图是图中的(填序号),另一个不能作为基态原子的电子排布图因为它不符合(填序号)。
①
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示: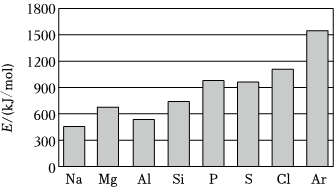
①同周期内,随着原子序数的增大,E值变化的总趋势是;
②根据图中提供的信息,可推断出E氧E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:、、。发布:2024/12/30 12:0:1组卷:37引用:2难度:0.61394.已知三种微粒(原子或离子)的电子排布式如下:11X:1s22s22p6,19Y:1s22s22p63s23p6,20Z:1s22s22p63s23p6.若将上述三种微粒归为同一类,下列微粒中也可归为此类的是( )
发布:2024/12/30 12:0:1组卷:45引用:8难度:0.81395.某有机物样品的质荷比如图所示(假设离子均带一个单位的正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
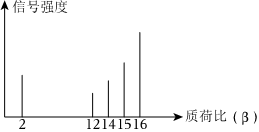 发布:2024/12/30 12:0:1组卷:49引用:9难度:0.9
发布:2024/12/30 12:0:1组卷:49引用:9难度:0.91396.(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.A的结构简式为
,名称为.A中的碳原子是否都处于同一平面?(填“是”或“不是”);A分子是否存在顺反异构体(填“是”或“否”)
(2)对下列物质进行系统命名: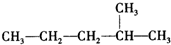 :;
:;
CH2=CHCH2CH3:;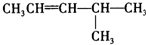 :;
:;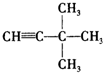 :;
:;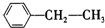 :.发布:2024/12/30 12:0:1组卷:34引用:2难度:0.5
:.发布:2024/12/30 12:0:1组卷:34引用:2难度:0.5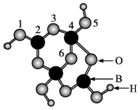 1397.硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题。
1397.硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题。
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,2号硼原子的杂化类型为;4号硼原子是否参与形成配位键?(填“是”或“否”)。
(2)BN中B的化合价为,请解释原因:。
(3)BF3和过量NaF作用可生成NaBF4,BF4-的空间结构为。发布:2024/12/30 12:0:1组卷:65引用:4难度:0.81398.下列各组元素中,按原子半径依次增大顺序排列的是( )
发布:2024/12/30 12:0:1组卷:32引用:2难度:0.91399.元素电负性随原子序数的递增而增强的是( )
发布:2024/12/30 12:0:1组卷:47引用:6难度:0.71400.20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子的空间结构。其要点可以概括为:
Ⅰ.用AXnEm表示只含一个中心原子的分子,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数。
Ⅱ.分子的空间结构是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对。
Ⅲ.分子中价层电子对、多重键之间的斥力的主要顺序是:
①孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;
②双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
③X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
④其他。请仔细阅读上述材料,回答下列问题。
(1)请填写表:
(2)请用VSEPR模型解释CO2为直线形分子的原因:VSEPR模型名称 正四面体形 n+m 2 价层电子对之
间的理想键角109.5° 。
(3)H2O分子的空间结构为,请你预测水分子中H-O-H键角的大小范围并解释原因:。
(4)SO2Cl2和SO2F2都属于AX4EO型分子,S与O之间以双键结合,S与Cl、S与F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构:,SO2Cl2分子中Cl-S-Cl键角(填“<”、“>”或“=”)SO2F2分子中F-S-F键角。发布:2024/12/30 12:0:1组卷:51引用:5难度:0.7



