当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1626
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1427
更新:2025年05月26日
|
381.根据构造原理写出下列基态原子或离子的电子排布式。
(1)A元素原子的M层电子数是L层电子数的一半。。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍。。
(3)基态N3-,Ni2+、Fe3+的电子排布式分别为,,。发布:2024/12/30 19:0:1组卷:4引用:2难度:0.6382.写出下列化合物的电子式:
水:二氧化碳:过氧化钠:.发布:2024/12/30 19:0:1组卷:68引用:2难度:0.5383.下列有关甲烷的取代反应的叙述正确的是( )
发布:2024/12/30 19:0:1组卷:146引用:7难度:0.9384.反应N2(g)+3H2(g)⇌2NH3(g)△H<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
发布:2024/12/30 19:0:1组卷:257引用:34难度:0.5385.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图A装置制备乙酸乙酯。
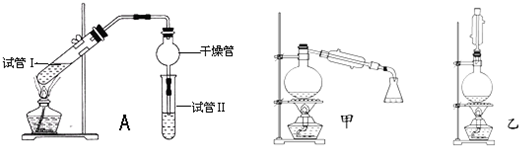
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:。与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是实验编号 试管Ⅰ中试剂 试管Ⅱ中试剂 有机层的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol•L-1浓硫酸饱和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol•L-1H2SO40.6 D 2mL乙醇、1mL乙酸、盐酸 0.6 mL和mol•L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图。图中内为适当的试剂,内为适当的分离方法。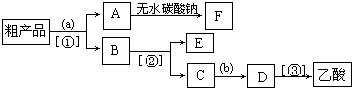
①试剂a是;分离方法②是,分离方法③是。分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后(填标号)。
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是。
(5)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为最合理的是。发布:2024/12/30 19:0:1组卷:84引用:3难度:0.1386.在光照条件下,分子式为C5H12的烷烃与氯气发生取代反应,生成物中含有两个氯原子且氯原子位于相邻碳原子上的结构最多有( )
发布:2024/12/30 19:0:1组卷:79引用:8难度:0.7387.美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。下表给出的是原子序数小于20的16种元素的电负性数值:
元素 H Li Be B C N O F 电负性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0
请仔细分析,试回答下列问题。元素 Na Mg Al Si P S Cl K 电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8
(1)根据表中所给数据分析推测:同主族的不同元素的电负性变化的规律是;同周期中,电负性与原子半径的关系为。
(2)预测周期表中电负性最大的元素应为(填元素符号);估计钙元素的电负性的取值范围为<Ca<。
(3)预测周期表中,电负性最小的元素位于第周期族(放射性元素除外),其基态原子核外电子排布式可表示为,与氯形成的化合物化学式为,属于(填“离子”或“共价”)化合物。发布:2024/12/30 19:0:1组卷:1引用:2难度:0.7388.化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是( )
发布:2024/12/30 19:0:1组卷:349引用:19难度:0.7389.下列说法正确的是( )
发布:2024/12/30 19:0:1组卷:1引用:2难度:0.6390.下列说法正确的是( )
发布:2024/12/30 19:0:1组卷:615引用:9难度:0.9



