当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1788
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1478
更新:2025年05月26日
|
491.在下列化学反应中,所断裂的共价键,仅仅断裂σ键的是( )
发布:2024/12/30 18:30:1组卷:7引用:3难度:0.7492.Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,这些元素的单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)七种元素中几种主族元素电负性从大到小的排列顺序为。
(2)下列Mg原子的核外电子排布式中,能量最高的是(填字母,下同),能量最低的是。
a.1s22s22p43s13px13py13pz1
b.1s22s22p33s23px13py13pz1
c.1s22s22p63s13px1
d.1s22s22p63s2
(3)N、O、Mg元素的部分电离能如表所示:
X、Y、Z中为N元素的是元素 I1/(kJ•mol-1) I2/(kJ•mol-1) I3/(kJ•mol-1) X 738 1451 7733 Y 1314 3388 5301 Z 1402 2856 4578 ,判断理由是。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是。Fe3+与Fe2+的离子半径大小关系为Fe3+(填“大于”或“小于”)Fe2+,原因为。发布:2024/12/30 18:30:1组卷:3引用:2难度:0.6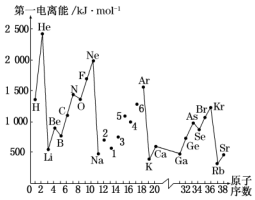 493.第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
493.第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
请回答以下问题:
(1)从图分析可知,同一主族元素原子的第一电离能I1的变化规律是.
(2)图中5号元素在周期表中的位置是、.
(3)图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:.
(4)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519kJ•mol-1,失去第二个电子为7296kJ•mol-1,失去第三个电子为11 799kJ•mol-1,由此数据分析为何锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量.发布:2024/12/30 18:30:1组卷:6引用:3难度:0.5494.1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,如表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:元素 H Li Be B C N O F 电负性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0 元素 Na Mg Al Si P S Cl K 电负性 0.9 1.2 1.5 1.7 2.1 2.3 3.0 0.8
(1)预测周期表中电负性最大的元素应为;估计钙元素的电负性的取值范围:<x<。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是;简述元素电负性X的大小与元素金属性、非金属性之间的关系。
(3)想验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为,其理由是。发布:2024/12/30 18:30:1组卷:9引用:2难度:0.5495.下列有关化学用语正确的是( )
发布:2024/12/30 18:30:1组卷:10引用:2难度:0.6496.有短周期A、B、C、D四种元素,A、B同周期,C、D同主族,已知A的阳离子与D的阴离子具有相同的电子层结构,B的阴离子和C的阴离子电子层结构相同,且C离子的核电荷数高于B离子,电负性顺序正确的是( )
发布:2024/12/30 18:30:1组卷:3引用:2难度:0.6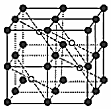 497.氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
497.氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是,中心原子的杂化方式为。NaBH4中存在(填标号)。
a.离子键
b.氢键
c.σ键
d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为。
(4)第三周期元素氟化物的熔点如表:
解释表中氟化物熔点变化的原因:化合物 NaF MgF2 AlF3 SiF4 PF5 SF6 熔点/℃ 993 1261 1291 -90 -83 -50.5 。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=g•cm-3(列出计算表达式)。发布:2024/12/30 18:30:1组卷:7引用:2难度:0.5498.下列离子半径的大小顺序正确的是( )
①Na+
②X2-:1s22s22p63s23p6
③Y2-:2s22p6
④Z-:3s23p6发布:2024/12/30 18:30:1组卷:16引用:7难度:0.6499.下列4组已知原子序数的元素,彼此间能形成共价键的是( )
发布:2024/12/30 18:0:1组卷:17引用:2难度:0.5500.回答下列问题:
(1)已知铜是29号元素,写出Cu的价层电子排布式,在元素周期表中的位置,该元素在(填“s”“p”“d”“f”或“ds”)区.
(2)写出与N同主族的As的基态原子的价电子排布图:.从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为.
(3)写出Fe2+的核外电子排布式:.
(4)下列三种晶体:①CO2,②NaCl,③金刚石,它们的熔点从低到高的顺序(填序号).发布:2024/12/30 18:0:1组卷:17引用:2难度:0.3



