当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1788
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1478
更新:2025年05月26日
|
521.某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
(1)写出该元素原子核外电子排布式
(2)指出该元素的原子序数,指出它在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价.发布:2024/12/30 18:0:1组卷:19引用:3难度:0.7522.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
发布:2024/12/30 18:0:1组卷:23引用:7难度:0.6523.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——30P,开创了人造核素的先河:27Al+4He-→30P+1n。下列有关说法不正确的是( )
发布:2024/12/30 18:0:1组卷:14引用:3难度:0.9524.A、B、C、D、E、F是元素周期表前四周期中的常见元素,其原子序数依次增大。A元素的一种核素的质量数是14,中子数是8;B元素基态原子的最外层有3个未成对电子,次外层有2个电子;C是地壳中含量最多的一种元素;D元素基态原子核外9个原子轨道上填充了电子且有1个未成对电子;E是一种常见的金属元素,可形成多种氧化物,其中一种氧化物是具有磁性的黑色物质;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。请完成以下空白:
(1)D元素的基态原子中,核外电子占据的最高能层的符号为,基态C离子占据的最高能级共有个原子轨道。
(2)B元素的基态原子价层电子的电子排布图为。
(3)请解释E3+离子比E2+离子稳定的原因:。
(4)基态F二价阳离子的核外电子排布式为。
(5)A、B、C三种元素的第一电离能从大到小为(用元素符号表示)。
(6)BD3与水反应产生有漂白性的物质,写出该反应的化学方程式。发布:2024/12/30 18:0:1组卷:26引用:4难度:0.6525.在下列6种物质中:①N2②CO2③CH2Cl2 ④C2H4⑤CaCl2 ⑥Na2O2,只含有非极性键的分子是
,既含离子键又含共价键的化合物是,只存在σ键的分子是,只存在1个π键的分子是。发布:2024/12/30 18:0:1组卷:16引用:2难度:0.6526.如图是某同学画的氮元素基态原子核外电子排布图,该电子排布图违背了下列哪个原理( )
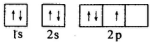 发布:2024/12/30 18:0:1组卷:19引用:2难度:0.9
发布:2024/12/30 18:0:1组卷:19引用:2难度:0.9527.下列物质的分子中,有π键的是( )
发布:2024/12/30 18:0:1组卷:13引用:3难度:0.5528.下列元素间易形成共价键的是( )
发布:2024/12/30 18:0:1组卷:24引用:4难度:0.9529.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.
下表是一些键能数据(KJ•mol-1):
回答下列问题:键能 键能 键能 键能 H-H 436 Cl-Cl 243 H-Cl 432 H-O 464 S=S 255 H-S 339 H-F 565 C-O 347 C-Cl 330 C-I 218 C-F 427
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固(填“能”或“不能”).能否从数据找出一些规律,请写出一条:;试预测C-Br键的键能范围<C-Br键能<.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是=185(KJ).发布:2024/12/30 18:0:1组卷:18引用:2难度:0.5530.(1)下列状态的镁中,电离最外层一个电子所需能量最大的是
(填标号)。
A.[Ne]
B.[Ne]
C.[Ne]
D.[Ne]
(2)Cu2+基态核外电子排布式为。
(3)Mn位于元素周期表中第四周期族,基态Mn原子核外未成对电子有个。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、(填标号)。
A.
B.
C.
D. 发布:2024/12/30 18:0:1组卷:21引用:3难度:0.6
发布:2024/12/30 18:0:1组卷:21引用:3难度:0.6



