当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1800
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1478
更新:2025年05月26日
|
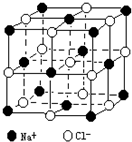 551.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
551.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3.
(1)步骤①中仪器A最好使用(填序号).
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用滴定管,能否用水代替苯,理由是.
(3)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德罗常数NA的表达式为.发布:2024/12/30 18:0:1组卷:22引用:2难度:0.1552.已知X、Y、Z、W、R都是周期表中前四周期的元素,它们的核电荷数依次增大。X原子有1个2p空轨道,Y原子最外层电子数等于X原子核外电子总数,Z与X同主族,W原子3p轨道只有一个单电子,R3+的3d轨道为半充满状态。回答下列问题:
(1)元素X、Y、Z的电负性由大到小的顺序是(用元素符号表示)。
(2)元素X、Z的最简单气态氢化物的沸点由高到低的顺序是(用化学式表示)。
(3)元素X、Y形成的一种化合物在高温高压下所形成的晶体其晶胞如图1所示,则该晶体类型属于晶体,1个晶胞中含有个X原子。
(4)如图2所示,R的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的图A~D中正确的是(填字母标号)。
假设R原子的半径是apm,则该晶体的密度的计算式是g•cm-3(用含a的式子表示,设阿伏加德罗常数的值为NA)。发布:2024/12/30 18:0:1组卷:18引用:2难度:0.4553.闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛地应用于军事、医学等领域,号称“崛起的第三金属”.已知钛有48Ti、49Ti、50Ti等核素,下列关于金属钛的叙述不正确的是( )
发布:2024/12/30 18:0:1组卷:34引用:6难度:0.5554.若某基态原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )
发布:2024/12/30 18:0:1组卷:16引用:2难度:0.7555.A,B,C,D,E代表5种元素.请按要求填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;其价层电子排布图为.
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素原子的名称为,C离子的结构示意图为
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为,其基态原子的电子排布式为,其原子的结构示意图为.
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子价层电子排布式为.发布:2024/12/30 18:0:1组卷:19引用:3难度:0.5556.(1)前四周期元素中E的最外层只有1个电子,但次外层有18个电子,E的价层电子排布图为
。
(2)Se原子核外M层电子的排布式为。
(3)基态硫原子的价电子排布式为。发布:2024/12/30 18:0:1组卷:17引用:4难度:0.8557.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
发布:2024/12/30 18:0:1组卷:25引用:2难度:0.9558.短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,基态X的原子的2p能级上只有一对成对电子,基态Y的原子的最外层电子运动状态只有1种,元素Z与X同主族。下列说法错误的是( )
发布:2024/12/30 18:0:1组卷:20引用:2难度:0.5559.( 1)比较离子半径:F-
(填“大于”“等于”或“小于”)O2-。
(2)Li+与H-具有相同的电子结构,r(Li+)小于r(H-),原因是。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),N、B、H三种元素电负性大小顺序是。
(4)光催化还原CO2制备CH4反应中,带状纳米 Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是。
(5)在周期表中,与Li的化学性质最相似的邻族元素是。
(6)下列状态的镁中,电离最外层一个电子所需能量最大的是(填字母)。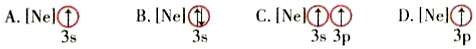
(7)黄铜是人类最早使用的合金之一,主要由Zn和 Cu组成。第一电离能I1(Zn)(填“大于”或“小于”)I1(Cu)。原因是。
(8)I1(Li)>I1(Na),原因是。I1(Be)>I1(B)>I1(Li),原因。
(9)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第2周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。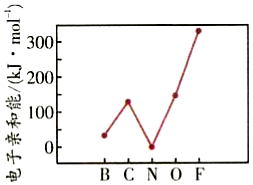 发布:2024/12/30 18:0:1组卷:21引用:2难度:0.3
发布:2024/12/30 18:0:1组卷:21引用:2难度:0.3560.已知各元素的原子核外电子排布图为:Be:
 ;N:
;N: ;Ne:
;Ne: ;Na:
;Na: ;Mg:
;Mg:
回答下列问题:
(1)只有K层与L层的元素有。( 填元素符号,下同)
(2)含有M层的元素有。
(3)最外层电子数相同的元素有。发布:2024/12/30 18:0:1组卷:26引用:4难度:0.9



