当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1897
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1492
更新:2025年05月26日
|
591.多电子原子中,有关叙述错误的是( )
发布:2024/12/30 17:30:1组卷:39引用:2难度:0.7592.(1)Cl原子核外能量最高的电子所在的能级是
。
(2)基态Si原子中,核外电子占据最高能层的符号为,该能层有个能级,电子数为。发布:2024/12/30 17:30:1组卷:39引用:3难度:0.8593.某课外活动小组同学用如图1装置进行实验,试回答下列问题.
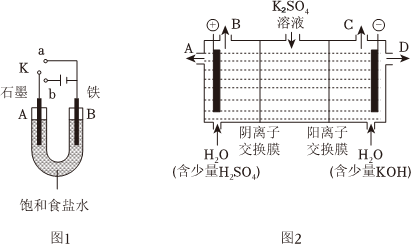
(1)若开始时开关K与b连接,则B极的电极反应式为,总反应的离子方程式为.有关上述实验,下列说法正确的是(填序号).
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为.
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
①该电解槽的阳极反应式为.此时通过阴离子交换膜的离子数(填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为.
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等.液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢.利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:.发布:2024/12/30 17:30:1组卷:35引用:3难度:0.5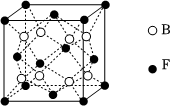 594.已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
594.已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(1)写出A元素的基态原子价电子排布式;F离子电子排布式.
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:.
(4)CE、FA的晶格能分别为786kJ/mol l、3401kJ/mo,试分析导致两者晶格能差异的主要原因是:.
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式).发布:2024/12/30 17:30:1组卷:27引用:8难度:0.5595.下列物质既含有离子键又含有共价键的化合物是( )
发布:2024/12/30 17:30:1组卷:38引用:2难度:0.5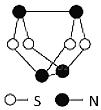 596.现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中如图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )发布:2024/12/30 17:30:1组卷:28引用:3难度:0.6
596.现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中如图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )发布:2024/12/30 17:30:1组卷:28引用:3难度:0.6597.根据要求完成下列问题:
(1)有以下物质:①CHCl3 ②C2H4 ③CS2 ④SO2 ⑤H2O2
含有非极性键的非极性分子是;以极性键相结合,具有直线型结构的非极性分子是;以极性键相结合,具有四面体形结构的极性分子是;以极性键相结合,具有V型结构的极性分子是;
(2)在Si、SiC、NaCl、H2S中,能形成分子晶体的化合物是,属于离子晶体的是,四种物质形成的晶体熔点由高到低的顺序是>>>.发布:2024/12/30 17:30:1组卷:38引用:2难度:0.5598.【物质结构与性质】
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
(1)基态砷的价电子排布式是.
(2)下列有关氮、磷、硫、氯的说法不正确的是.
a.第一电离能由小到大的顺序是S<P<Cl
b.NH3、PH3、AsH3三种物质中沸点最低的是AsH3
c.PO43-、SO42-、ClO4-互为等电子体,它们的空间构型均为四面体
d.化合物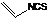 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
(3)对CoCl3•5NH3的研究表明:①CoCl3•5NH3和硝酸银溶液作用时,其中两个氯离子迅速沉淀,第三个氯离子沉淀缓慢;②溶液导电性测量表明,含1mol CoCl3•5NH3的溶液中含有3mol离子,则配合物中配离子的化学式是.
(4)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为.在四大晶体类型中,GaN属于晶体,晶体结构中存在的化学键有(填序号)
a.离子键b.共价键c.分子间作用力d.配位键
(5)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式).
(6)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1若该反应中有4mol N-H键断裂,则形成的π键有mol.发布:2024/12/30 17:30:1组卷:37引用:2难度:0.1599.现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为了A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 B元素原子的核外p电子数比s电子数少1 C元素基态原子p轨道有两个未成对电子 D原子的第一至第四电离能分别是:Ⅰ1=738kJ•mol-1;Ⅰ2=1451kJ•mol-1;Ⅰ3=7733kJ•mol-1;Ⅰ4=10540kJ•mol-1; E原子核外所有p轨道全满或半满 F在周期表的第8纵列 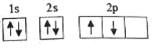 ,该同学所画的电子排布图违背了 。
,该同学所画的电子排布图违背了 。
(2)B元素的电负性(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为。
(4)E基态原子中能量最高的电子,其电子云在空间有个方向。
(5)下列关于F原子的价层电子排布图正确的是。
a.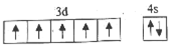 b.
b.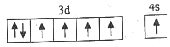
c.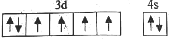 d.
d.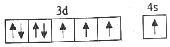
(6)基态F3+离子核外电子排布式为。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ•mol-1,INi=1753kJ•mol-1,ICu>INi原因是。发布:2024/12/30 17:30:1组卷:32引用:3难度:0.5600.下列说法正确的是( )
发布:2024/12/30 17:30:1组卷:42引用:4难度:0.7



