如图是一个趣味变色实验,同学们对混合后溶液变色时间的影响因素进行探究。
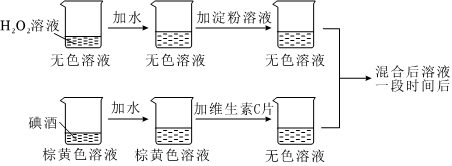
资料:碘酒为碘(I2)的乙醇溶液;淀粉遇I2变蓝,在本实验中作为指示剂,指示I2是否存在。
【进行实验】向烧杯A中加入一定体积的3%H2O2溶液、水和2mL1%淀粉溶液。
向烧杯B中加入一定体积的2%碘酒、水和2粒维生素C片,将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间。
| 序号 | 烧杯A | 烧杯B | 变色时间/s | ||
| H2O2溶液体积/mL | 溶液总体积/mL | 碘酒体积/mL | 溶液总体积/mL | ||
| ① | 10 | 32 | 2 | 25 | 595 |
| ② | 10 | 32 | 5 | 25 | 193 |
| ③ | 10 | 32 | 10 | 25 | 39 |
| ④ | 5 | 32 | 5 | 25 | 399 |
| ⑤ | 20 | 32 | 5 | 25 | 78 |
【解释与结论】
(1)H2O2溶液中,溶质是
H2O2
H2O2
;(2)①②③的目的是
探究碘酒体积对混合后溶液变色时间的影响
探究碘酒体积对混合后溶液变色时间的影响
;(3)由②④⑤可以得到的结论是
在其他条件相同的情况下,加入的H2O2溶液越多,越有利于反应的进行,混合后溶液由无色变为蓝色的时间就越短
在其他条件相同的情况下,加入的H2O2溶液越多,越有利于反应的进行,混合后溶液由无色变为蓝色的时间就越短
;(4)①中,若将碘酒体积改为1mL,则混合后溶液变色时间
>
>
(填“>”或“<”或“=”)595s。【继续实验】
(5)补做实验证明了维生素C用量对混合后溶液变色时间也有影响。实验方案:向烧杯A中加入20mL3%H2O2溶液、10mL水、2mL1%淀粉溶液,
向烧杯B中加入5mL2%碘酒、一定体积的水,使溶液总体积为 25mL、5粒维生素C片,然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间
向烧杯B中加入5mL2%碘酒、一定体积的水,使溶液总体积为 25mL、5粒维生素C片,然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间
。(6)同学们进一步证明了I2与维生素C能发生反应,实验是向烧杯中依次加入碘酒、水、淀粉溶液,再加入维生素C片,实验过程中观察到
溶液由棕黄色变为蓝色再变为无色
溶液由棕黄色变为蓝色再变为无色
。【答案】H2O2;探究碘酒体积对混合后溶液变色时间的影响;在其他条件相同的情况下,加入的H2O2溶液越多,越有利于反应的进行,混合后溶液由无色变为蓝色的时间就越短;>;向烧杯B中加入5mL2%碘酒、一定体积的水,使溶液总体积为 25mL、5粒维生素C片,然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间;溶液由棕黄色变为蓝色再变为无色
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/7 8:0:9组卷:558引用:6难度:0.2
相似题
-
1.实验小组研究几种常用胃药的抗酸效果。
【查阅资料】
i.溶液的pH越大,酸性越弱。人体胃液的主要成分为盐酸,正常pH范围为0.9~1.5。
ⅱ.三种胃药的有效成分如下。胃药使用不当,可能导致胃胀气等症状。
【进行实验】胃药a 胃药b 胃药c 碳酸氢钠
NaHCO3铝碳酸镁
Al2Mg6(OH)16CO3•4H2O氢氧化铝
Al(OH)3
实验一:验证胃药是否能抗酸
各取25mLpH=1.20的稀盐酸放入三个小烧杯中,分别加入有效成分质量相同的三种胃药,搅拌120s,观察实验现象并用pH传感器测定反应后溶液的pH。
(1)胃药a和胃药b产生的气体均为CO2,实验室检验该气体的试剂是现象 反应后溶液的pH 胃药a 产生大量气体 6.37 胃药b 产生极少量气体 4.25 胃药c 无气体 1.34 。
(2)胃药c中的氢氧化铝与盐酸发生中和反应,其化学方程式为。
(3)由实验一可知三种胃药都能抗酸,依据是。
实验二:探究影响胃药抗酸效果的因素
下表所示实验中,均取25mLpH=1.20的稀盐酸,加入胃药,搅拌,用pH传感器测定一定反应时间后溶液的pH(反应后pH越大,抗酸效果越好)。
(4)探究反应时间对胃药抗酸效果的影响的实验组合是实验编号 胃药种类 有效成分质量/g 反应时间/s 溶液的pH ① 胃药a 0.5 60 6.02 ② 胃药a 0.5 120 6.37 ③ 胃药a 0.5 180 6.54 ④ 胃药b 0.5 60 3.93 ⑤ 胃药b 0.5 120 4.25 ⑥ 胃药b 0.5 180 4.70 ⑦ 胃药c 0.5 60 1.26 ⑧ 胃药c 0.5 120 1.34 ⑨ 胃药c 0.5 180 1.42 (填序号,任写一个组合)。
(5)由实验二可知,胃药种类对抗酸效果的影响的结论是。
【反思与评价】
(6)实际应用中,胃药b比胃药a、c使用得更多。结合上述实验,说明胃药b具有的优势是。发布:2024/12/25 13:0:1组卷:179引用:2难度:0.5 -
2.如图1为实验室常用的制取气体的实验装置。
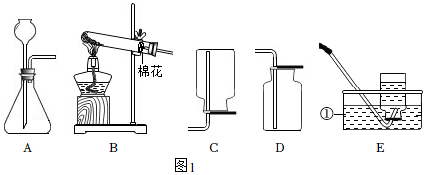
(1)写出标有序号的仪器名称:①。
(2)用装置B和E组合制取氧气,反应方程式为,若实验结束时先熄灭酒精灯,再移出导气管,导致的后果为。
(3)实验室用稀硫酸和锌粒制取氢气的反应方程式为,用A装置做发生装置,检查装置气密性时用止水夹夹紧导管,向长颈漏斗中加入水,若出现现象,则气密性良好。
(4)实验室用未知浓度的盐酸和大理石制取二氧化碳,反应方程式为。同学们将制得的气体通入澄清石灰水,未变浑浊。猜想可能的原因是:
①澄清石灰水已变质;
②气体中除了有CO2外,还有氯化氢气体。
经过讨论设计如图2装置进行探究。试管I、试管Ⅱ盛放AgNO3溶液,试管Ⅲ中盛放原瓶中的澄清石灰水。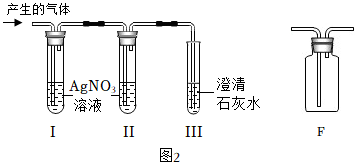
实验过程:
根据试管I中的现象,试管Ⅱ中硝酸银溶液未变浑浊,试管Ⅲ中的现象,同学们得出猜想①②两个原因均存在的结论。
问题讨论:
①试管Ⅱ中AgNO3溶液的作用为。
②同学们用F装置除去CO2中的氯化氢气体,F装置中的药品可选用(填序号)。
A.NaOH溶液
B.AgNO3溶液
C.饱和NaHCO3溶液发布:2024/12/24 8:0:11组卷:83引用:3难度:0.6 -
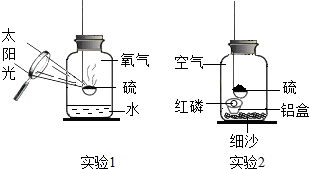 3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
【猜想】
甲同学猜想:硫燃烧耗尽了瓶内的氧气,所以它熄灭了;
乙同学猜想:硫燃烧后瓶内的二氧化硫(不支持硫的燃烧)浓度过高导致硫熄灭了;
丙同学猜想:甲和乙都只看到了问题的一个方面,他认为甲和乙都有道理;
丁同学猜想:.
【设计实验】丁同学设计了实验2进行实验验证自己的猜想:
【实验反思】(1)硫燃烧的化学方程式为实验步骤 实验现象 实验分析 实验结论 (1)把少量红磷放在铝制小盒内,然后放入装有细沙的集气瓶,塞紧瓶塞,用放大镜点燃硫,观察现象. 硫燃烧一会儿就熄灭了. 磷燃烧需满足的条件:①温度达到着火点;
②丁同学的猜想正确. (2)待冷却后,用放大镜聚光加热铝盒内的红磷,观察现象. 红磷燃烧,放出热量的同时产生了 ;实验2中硫燃烧的火焰颜色是色.
(2)实验1与课本实验相比,实验1的优点是;
(3)实验2中细沙的作用是.
(4)实验室中测定空气中氧气体积分数实验不用硫代替红磷的原因是.发布:2024/12/2 8:0:1组卷:31引用:1难度:0.5
相关试卷


