光伏材料是能将太阳能直接转换成电能的材料,又称太阳能材料,只有半导体材料具有这种功能。可做太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。请回答下列问题:
(1)已知Ga与B同主族,基态Ga原子的原子结构示意图为 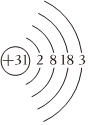
 。Ga失去电子的逐级电离能(单位:kJ⋅mol-1)的数值依次为577、1984.5、2961.8、6192。由此可推知镓的主要化合价为 +1+1和+3。
。Ga失去电子的逐级电离能(单位:kJ⋅mol-1)的数值依次为577、1984.5、2961.8、6192。由此可推知镓的主要化合价为 +1+1和+3。
(2)Cd为第48号元素,Cd在元素周期表中的位置为 第五周期第ⅡB族第五周期第ⅡB族,电子占据的最高能级的原子轨道的电子云轮廓图为 球形球形。
(3)下列事实能说明硫的非金属性比磷强的是 BCBC(填字母);
A.沸点:PH3<H2S
B.稳定性:PH3<H2S
C.酸性:H3PO4<H2SO4
从原子结构角度解释硫的非金属性比磷强的原因:S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强。
(4)与Al在元素周期表中处于对角线的铍,在性质上与Al具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成Na2BeO2的离子方程式 BeO+2OH-=BeO2-2+H2OBeO+2OH-=BeO2-2+H2O。
(5)GaN、GaP、GaAs熔融状态均不导电,它们的晶体结构与金刚石相似,其熔点如下表所示,试分析GaN、GaP、GaAs的熔点依次降低的原因:这几种物质都是共价晶体,N、P、As的原子半径依次增大,则Ga-N、Ga-P、Ga-N的键长依次增大,键能依次减小,导致GaN、GaP、GaAs熔点依次降低这几种物质都是共价晶体,N、P、As的原子半径依次增大,则Ga-N、Ga-P、Ga-N的键长依次增大,键能依次减小,导致GaN、GaP、GaAs熔点依次降低。


B
e
O
2
-
2
B
e
O
2
-
2
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
【答案】 ;+1;第五周期第ⅡB族;球形;BC;S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强;BeO+2OH-=+H2O;这几种物质都是共价晶体,N、P、As的原子半径依次增大,则Ga-N、Ga-P、Ga-N的键长依次增大,键能依次减小,导致GaN、GaP、GaAs熔点依次降低
;+1;第五周期第ⅡB族;球形;BC;S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强;BeO+2OH-=+H2O;这几种物质都是共价晶体,N、P、As的原子半径依次增大,则Ga-N、Ga-P、Ga-N的键长依次增大,键能依次减小,导致GaN、GaP、GaAs熔点依次降低
 ;+1;第五周期第ⅡB族;球形;BC;S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强;BeO+2OH-=
;+1;第五周期第ⅡB族;球形;BC;S和P是同周期元素,原子半径S<P,硫得到电子能力增强,非金属性越强;BeO+2OH-=B
e
O
2
-
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/19 8:0:9组卷:12引用:1难度:0.7
相似题
-
1.已知Al、Mg、Na为第三周期元素,其原子的第一至第四电离能如下表:
(1)则Al、Mg、Na的电负性从大到小的顺序为电离能/kJ•mol-1 I1 I2 I3 I4 X 578 1817 2745 11578 Y 738 1451 7733 10540 Z 496 4562 6912 9543 ;
(2)C、N、O、H是周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取杂化;
②CH4是含有键(填“极性”或“非极性”)的分子(填“极性”或“非极性”);
③NH3是一种易液化的气体,请简述其易液化的原因;
④H2O分子的VSEPR模型的空间构型为,H2O分子的空间构型为;
(3)K、Cr、Cu三种元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①K元素组成的单质的晶体堆积模型为(填代号);
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
②Cr元素在其化合物中最高化合价为;
③Cu2+离子的核外电子排布式为。发布:2025/1/5 8:0:1组卷:3引用:1难度:0.7 -
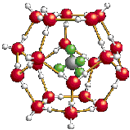 2.我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:
2.我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:
(1)C、N、O三种元素第一电离能由大到小的排列顺序是>>(填元素符号),H2O分子中O原子的杂化方式为.
(2)“可燃冰”晶体内部存在的作用力有.
(3)下列有关“可燃冰”的说法中,不正确的是.
A.“可燃冰”的存在说明甲烷易溶于水
B.“可燃冰”属于分子晶体,熔点较低
C.相同条件下,“可燃冰”的密度比冰的大
D.“可燃冰”只能在低温、高压环境下稳定存在
(4)晶体中平均每46个水分子构成8个笼,每个笼可容纳1个CH4分子或1个H2O分子,每8个笼中有6个容纳CH4分子,2个笼填充H2O分子,则“可燃冰”(天然气水合物)的平均组成可表示为.发布:2024/12/31 8:0:1组卷:23引用:1难度:0.3 -
3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为,其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为(用元素符号表示)。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)。
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+.该阴离子的电子式为,σ键和π键的数目之比为。其空间构型为。
(4)K3[Fe(CN)6]晶体中配离子的配位体为(用化学符号表示)发布:2025/1/5 8:0:1组卷:19引用:1难度:0.6


