Ⅰ.KI在经酸化的溶液中被空气氧化生成I2。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液/mL | 出现蓝色时间/s |
| A | 40 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(1)写出该反应的离子方程式
4H++4I-+O2=2I2+2H2O
4H++4I-+O2=2I2+2H2O
;(2)为确保A组实验在40℃下进行,实验操作是
将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度
将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度
。(3)B组实验中“没出现蓝色”,原因是
温度(TB)高于75℃,淀粉与碘不显色
温度(TB)高于75℃,淀粉与碘不显色
。(4)请你为小组设计D组实验方案,填写空格。以帮助小组完成探究目标。
(5)按你设计的实验数据,请你预测一个t值
设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值
设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值
,并写出与你预测相对应的探究实验的结论 其他条件不变时,酸度越大反应速率越快
其他条件不变时,酸度越大反应速率越快
。Ⅱ.测定中和反应的反应热
(6)①取60mL0.50mol/LNaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ |
温度差 (t2-t1)/℃ |
||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.9 | |
| 2 | 26.2 | 26.4 | 26.3 | 30.6 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.5 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.0 | |
-
4
.
18
J
/
(
g
•
℃
)
×
(
50
+
60
)
g
×
3
.
7
℃×
1
0
-
3
k
J
/
J
0
.
060
L
×
0
.
5
mol
/
L
-
4
.
18
J
/
(
g
•
℃
)
×
(
50
+
60
)
g
×
3
.
7
℃×
1
0
-
3
k
J
/
J
0
.
060
L
×
0
.
5
mol
/
L
②能引起中和反应的反应热数值偏高的原因是(填字母)
B
B
。A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E.量取硫酸溶液的体积时仰视读数
【考点】探究影响化学反应速率的因素;中和热的测定实验.
【答案】4H++4I-+O2=2I2+2H2O;将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度;温度(TB)高于75℃,淀粉与碘不显色;设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值;其他条件不变时,酸度越大反应速率越快;;B
-
4
.
18
J
/
(
g
•
℃
)
×
(
50
+
60
)
g
×
3
.
7
℃×
1
0
-
3
k
J
/
J
0
.
060
L
×
0
.
5
mol
/
L
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/11 17:0:2组卷:35引用:1难度:0.5
相似题
-
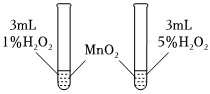 1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6
1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6 -
2.为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题(已知:Cu2+、Fe3+对H2O2的分解起催化作用)。
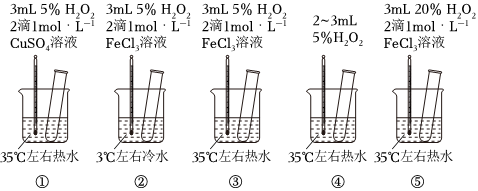
(1)为探究温度对化学反应速率的影响,应选择实验(填序号,下同),选择的依据是。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
(3)通过观察发现实验⑤比实验③现象明显,其原因是。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为。发布:2024/12/30 14:30:1组卷:8引用:5难度:0.5 -
 3.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
3.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是实验序号 实验目的 T/K pH c/10-3mol•L-1 H2O2 Fe2+ ① 为以下实验作参照物 298 3 6.0 0.30 ② 探究温度对降解反应速率的影响 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
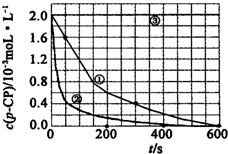
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=.
(3)实验①②表明,温度与该降解反应速率的关系是.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为c(I-)/(mol•L-1) c(Fe3+)/(mol•L-1) v/(mol•L-1•s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为.发布:2024/12/30 14:30:1组卷:20引用:2难度:0.5


