某实验小组利用如图装置模拟古法硫酸生产方法并进行SO2性质探究。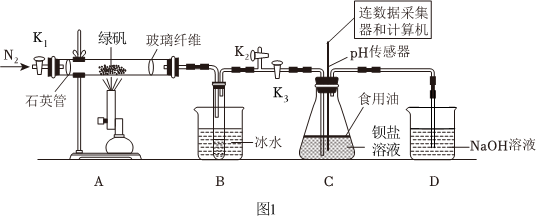
已知:①“绿矾”是FeSO4•7H2O,高温受热可完全分解,得到红棕色固体和气体混合物;
②SO2熔点-75.5℃沸点-10℃;SO3熔点16.8℃沸点44.8℃。
请回答下列问题:
Ⅰ.制取硫酸。
实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,用酒精喷灯高温加热绿矾。
(1)A装置发生的化学方程式为 2FeSO4•7H2O 高温 Fe2O3+SO2↑+SO3↑+14H2O2FeSO4•7H2O 高温 Fe2O3+SO2↑+SO3↑+14H2O。
(2)B装置的作用 冷凝H2O与SO3制H2SO4,并分离出SO2冷凝H2O与SO3制H2SO4,并分离出SO2。
(3)实验结束后,再打开活塞K1,通入一段时间N2,这样做的目的 将装置中残留的气体赶入尾气吸收装置中,防止污染空气,将装置中残留的气体赶入尾气吸收装置中,防止污染空气,。
(4)将一定量的绿矾在500℃时隔绝空气加强一段时间后,检验其固体产物,请设计实验证明此固体产物不含二价铁:取少量固体于试管中,加稀硫酸溶液,再滴入少量高锰酸钾溶液,溶液不褪色取少量固体于试管中,加稀硫酸溶液,再滴入少量高锰酸钾溶液,溶液不褪色。
Ⅱ.探究SO2的性质。
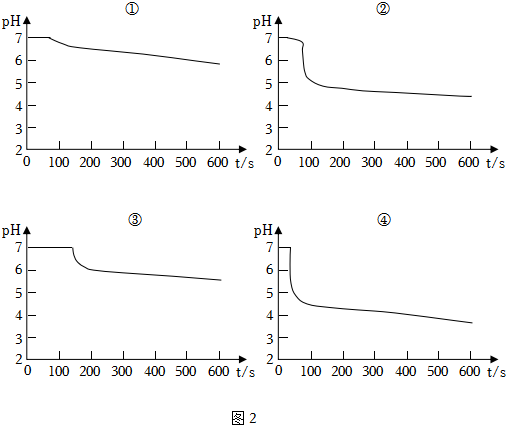
在装置C中先后四次加入同浓度、同体积、不同情况的钡盐溶液,油层厚度一致,通入SO2流速一致。三次实验现象如下表:
高温
高温
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
(5)装置C覆盖油层的目的
隔绝空气,避免空气中氧气干扰后续探究实验
隔绝空气,避免空气中氧气干扰后续探究实验
。(6)分析曲线③发生的离子方程式
3SO2+3Ba2++2+2H2O=3BaSO4↓+2NO↑+4H+
NO
-
3
3SO2+3Ba2++2+2H2O=3BaSO4↓+2NO↑+4H+
,上诉四次实验中有白色沉淀的是 NO
-
3
②③④
②③④
(填编号)。【答案】2FeSO4•7H2O Fe2O3+SO2↑+SO3↑+14H2O;冷凝H2O与SO3制H2SO4,并分离出SO2;将装置中残留的气体赶入尾气吸收装置中,防止污染空气,;取少量固体于试管中,加稀硫酸溶液,再滴入少量高锰酸钾溶液,溶液不褪色;隔绝空气,避免空气中氧气干扰后续探究实验;3SO2+3Ba2++2+2H2O=3BaSO4↓+2NO↑+4H+;②③④
高温
NO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/28 5:0:8组卷:9引用:1难度:0.5
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
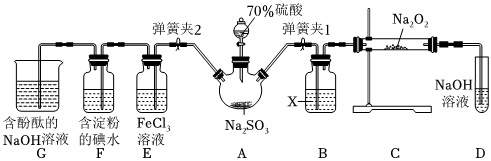
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
 2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
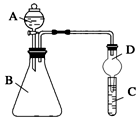
3.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色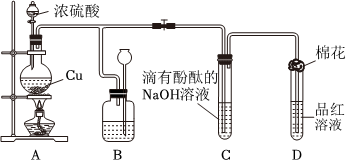 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7


