学习了酸碱盐的知识后,化学小组通过探究活动进一步理解复分解反应的实质。
(1)查阅资料:
一定体积的溶液中,离子的数目越多,其离子的浓度越大。电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。相同温度下,同种溶液电导率越大,离子浓度越大。
(2)设计实验:
实验一:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,再逐滴滴入稀H2SO4溶液,测得溶液的电导率变化如图1曲线所示。
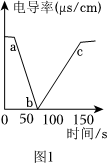
①写出反应的化学方程式:Ba(OH)2+H2SO4=BaSO4↓+2H2OBa(OH)2+H2SO4=BaSO4↓+2H2O
②溶液电导率在b点时几乎为0,原因是什么?b点时,Ba(OH)2与H2SO4恰好完全反应,生成BaSO4沉淀与水,溶液中自由移动的离子浓度几乎为零b点时,Ba(OH)2与H2SO4恰好完全反应,生成BaSO4沉淀与水,溶液中自由移动的离子浓度几乎为零
实验二:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,再逐滴滴入稀Na2SO4溶液,测得溶液的电导率变化如图2曲线所示。
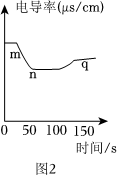
③通过对图2曲线的分析,下列说法错误的是 ACAC(填序号)。
A.实验过程中,溶液由红色变为无色
B.实验过程中,溶液中Na+浓度逐渐增加
C.实验过程中,m~n段电导率降低是由于反应生成了沉淀
D.n点时溶液电导率仍然较大,表明溶液中还存在较多离子
④图2中的q点时,溶液中含有的离子是 Na+、OH-、SO2-4Na+、OH-、SO2-4(填离子符号)。
(3)得出结论:
通过比较分析,结合已学知识可知,复分解反应的实质是:参与反应的离子结合生成了沉淀、气体或水,导致溶液中离子浓度 减小减小(填“增大”、“减小”或“不变”)。
(4)拓展反思:
①恒温条件下,向100mL同浓度的稀Ba(OH)2溶液中滴加稀CuSO4溶液,请你预测,溶液的电导率变化与 图1图1(填“图1”或“图2”)的曲线更接近。
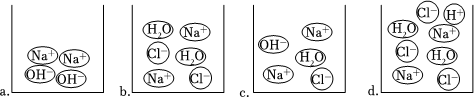
②如图是向NaOH溶液中逐滴滴加稀盐酸过程中,不同时间点烧杯中的微观粒子示意图,按时间先后排列的顺序为 acbdacbd(填字母序号)。
(5)某工厂利用熟石灰和纯碱反应制备氢氧化钠,试计算:制备10吨氢氧化钠固体,至少需要含杂质为7.5%的熟石灰是多少吨?
SO
2
-
4
SO
2
-
4
【考点】复分解反应的实质与应用.
【答案】Ba(OH)2+H2SO4=BaSO4↓+2H2O;b点时,Ba(OH)2与H2SO4恰好完全反应,生成BaSO4沉淀与水,溶液中自由移动的离子浓度几乎为零;AC;Na+、OH-、;减小;图1;acbd
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/22 8:0:8组卷:69引用:2难度:0.5
相似题
-
1.下列各组溶液,相互能发生反应的是( )
发布:2024/12/25 16:0:1组卷:119引用:7难度:0.9 -
2.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。

(1)如图1是镁原子和锶原子结构示意图。
①镁和锶两种元素的最本质区别是。
②锶与地壳中含量最多的元素形成的化合物为(填化学式)。
③元素的性质与其原子结构有密切关系。原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,原子核对最外层电子的吸引力越小。由此推测,锶(Sr)的金属的活动性比镁(Mg)的金属活动性(填“强”或“弱”)。
(2)氮及其化合物的“化合价-物质类别”关系图如图2。
①甲在空气中的体积分数为;丙的化学式为HNO3,该物质的名称是。
②若丁是工业用盐NaNO2,能区别NaNO2溶液与食盐溶液的一种试剂是。(友情提示:NaNO2有毒,有咸味,外形与食盐相似,其水溶液呈碱性,AgNO2微溶于水。)
(3)图3描述了NaOH与NaHSO4两溶液反应的微观示意图。
①NaHSO4物质类别属于(填“酸”、“碱”或“盐”)。
②写出与该反应微观本质相同的另一化学方程式。发布:2024/12/24 9:0:1组卷:125引用:2难度:0.7 -
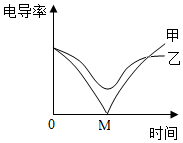 3.电导率传感器可辅助探究复分解反应的实质,相同条件下,离子浓度越大,电导率越大,溶液导电性越强.将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示.下列说法正确的是( )发布:2024/12/25 11:0:2组卷:176引用:4难度:0.5
3.电导率传感器可辅助探究复分解反应的实质,相同条件下,离子浓度越大,电导率越大,溶液导电性越强.将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示.下列说法正确的是( )发布:2024/12/25 11:0:2组卷:176引用:4难度:0.5


