某小组同学制备碘酸盐(IO-3)并探究其性质.
资料:①I2可与NaOH溶液反应生成IO-3和I-.
②碘酸钙[Ca(IO3)2]为难溶于水、能溶于硝酸的白色固体.
③X2的氧化性,X-的还原性与溶液的酸碱性无关:IO-3与氧化性随溶液酸性增强而增强(X为Cl、Br或I).
实验装置如图(加热与夹持装置略):
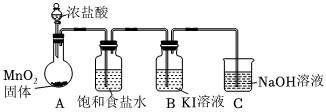
步骤:
Ⅰ.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色.
Ⅱ.将B中棕黄色溶液倒入烧杯中,再加入NaOH溶液,烧杯中溶液由棕黄色变为无色.
(1)A装置发生的化学方程式为 MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O.
(2)C装置发生的离子方程式为 Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O.
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和CCl4,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色.甲同学得出结论:在酸性条件下IO-3可以氧化I-为I2.
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中O2在酸性条件下将溶液中的I-氧化,离子方程式为 4I-+O2+4H+=2I2+2H2O4I-+O2+4H+=2I2+2H2O.
原因二:HClOHClO(填化学式)在酸性条件下将溶液中的I-氧化.
②为了进一步证明在酸性条件下IO-3可氧化I-为I2,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量CaCl2固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y.
ⅱ.向无色溶液X,加入与(3)等量的盐酸和CCl4,振荡后静置,溶液分层,上、下层均几乎无色.
ⅲ.取少量洗涤后的沉淀Y加入稀HNO3,固体溶解,继续加入少量KI溶液,溶液呈黄色.
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:不含有碘酸根离子时,酸性条件下空气中的氧气或次氯酸未将碘离子氧化生成碘单质不含有碘酸根离子时,酸性条件下空气中的氧气或次氯酸未将碘离子氧化生成碘单质.
b.由实验ⅲ和ⅳ得出结论:在酸性条件下IO-3可以氧化I-为I2.补全实验ⅳ的操作和现象 继续加入过量的氯化钙溶液,不产生白色沉淀或产生很少白色沉淀继续加入过量的氯化钙溶液,不产生白色沉淀或产生很少白色沉淀.
(4)根据实验ⅲ得出:氧化性I2<<IO-3(填“>”或“<”),而实验ⅰ表明I2和IO-3的氧化性强弱关系相反,原因是 碘酸根离子的氧化性与溶液的酸碱性有关,溶液酸性越强,碘酸根离子氧化性越强碘酸根离子的氧化性与溶液的酸碱性有关,溶液酸性越强,碘酸根离子氧化性越强.
(5)查阅资料发现,XO-3与相应的X-(X=Cl,Br)均有类似上述反应.浓度相同时,氧化性ClO-3≈BrO-3,但浓度均为0.1mol/L的ClO-3和Cl-开始发生反应时的pH为1,而浓度均为0.1mol/L的BrO-3和Br-开始发生反应的pH为5.试从原子结构的角度解释两个反应开始发生时pH不同的原因 氯离子的还原性弱于溴离子,所以氯酸根离子氧化氯离子需要酸性更强才能氧化氯离子的还原性弱于溴离子,所以氯酸根离子氧化氯离子需要酸性更强才能氧化.
IO
-
3
IO
-
3
IO
-
3
△
△
IO
-
3
IO
-
3
IO
-
3
IO
-
3
IO
-
3
XO
-
3
C
l
O
-
3
B
r
O
-
3
C
l
O
-
3
B
r
O
-
3
【考点】性质实验方案的设计.
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;4I-+O2+4H+=2I2+2H2O;HClO;不含有碘酸根离子时,酸性条件下空气中的氧气或次氯酸未将碘离子氧化生成碘单质;继续加入过量的氯化钙溶液,不产生白色沉淀或产生很少白色沉淀;<;碘酸根离子的氧化性与溶液的酸碱性有关,溶液酸性越强,碘酸根离子氧化性越强;氯离子的还原性弱于溴离子,所以氯酸根离子氧化氯离子需要酸性更强才能氧化
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/20 6:0:10组卷:102引用:5难度:0.4
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
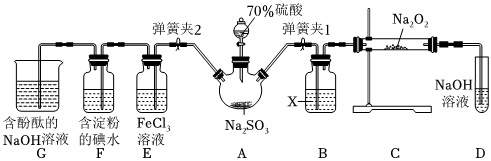
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
 2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
2.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
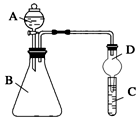
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
3.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色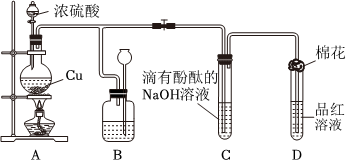 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7


