ZB是常用的阻燃剂,主要成分是硼酸锌(B2O6Zn3)。某研究小组展开对ZB性质的系列探究活动。
【查阅资料】
①用硼酸(H3BO3)与ZnO、H2O合成ZB,ZB的组成会受温度等合成条件的影响。
②ZB受热,先释放出水;当温度高于350℃,生成ZnO和B2O3固体;继续升温到400℃以上,B2O3熔化为玻璃态物质。
【知识应用】ZB起阻燃作用的原因是 降低温度至可燃物的着火点以下,隔绝氧气降低温度至可燃物的着火点以下,隔绝氧气(写出一种即可);当温度高于350℃,发生反应的化学方程式为 B2O6Zn3350℃以上 3ZnO+B2O3B2O6Zn3350℃以上 3ZnO+B2O3。
【探究实验Ⅰ】研究温度对合成的ZB组成的影响
研究小组在不同温度下制取ZB,实验数据如下。
B
2
O
6
Z
n
3
350
℃
以上
3
Z
n
O
+
B
2
O
3
B
2
O
6
Z
n
3
350
℃
以上
3
Z
n
O
+
B
2
O
3
| m(H3BO3)/g | m(ZnO)/g | V(H2O)/mL | t/℃ | |
| 实验1 | 28 | 10 | 100 | 94 |
| 实验2 | x | 10 | 100 | 98 |
| 实验3 | 28 | y | 100 | 102 |
28
28
和 10
10
。【探究实验Ⅱ】检测102℃时合成的ZB含水的质量分数
同学利用如图装置(夹持仪器已略)进行实验。
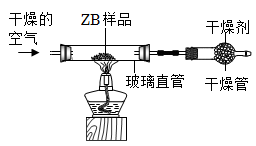
①需要不断通入干燥空气的目的是
将产生的水蒸气全部从玻璃直管中排出
将产生的水蒸气全部从玻璃直管中排出
。②实验时,需要称量获得的数据有:ZB样品的质量、
含样品的玻璃直管反应前后
含样品的玻璃直管反应前后
的质量。【探究实验Ⅲ】评估102℃时合成的ZB的阻燃性能。
进行木材粉末灼烧残重实验:某温度下,灼烧质量相同的两份干燥的木材粉末(一份经ZB处理)30min测量残留固体质量:调整温度,重复实验,得到木材粉末灼烧后固体残留率(w)随温度变化关系如图。
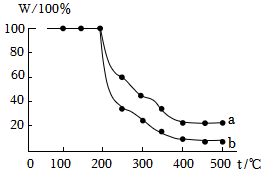
(注:ω=
残留固体质量
木材粉末质量
①低于200℃时,两份木材粉末质量均保持不变的原因是
温度没有达到木材的着火点,木材还未燃烧
温度没有达到木材的着火点,木材还未燃烧
。②图中曲线
a
a
(填“a”或“b”)对应的木材粉末是经ZB处理的。【讨论与反思】为寻找阻燃性能最佳的ZB的合成温度,应开展的实验是
在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
。【答案】降低温度至可燃物的着火点以下,隔绝氧气; ;28;10;将产生的水蒸气全部从玻璃直管中排出;含样品的玻璃直管反应前后;温度没有达到木材的着火点,木材还未燃烧;a;在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
B
2
O
6
Z
n
3
350
℃
以上
3
Z
n
O
+
B
2
O
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/23 8:0:8组卷:75引用:2难度:0.4
相似题
-
1.如图1为实验室常用的制取气体的实验装置。
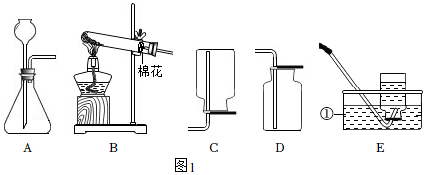
(1)写出标有序号的仪器名称:①。
(2)用装置B和E组合制取氧气,反应方程式为,若实验结束时先熄灭酒精灯,再移出导气管,导致的后果为。
(3)实验室用稀硫酸和锌粒制取氢气的反应方程式为,用A装置做发生装置,检查装置气密性时用止水夹夹紧导管,向长颈漏斗中加入水,若出现现象,则气密性良好。
(4)实验室用未知浓度的盐酸和大理石制取二氧化碳,反应方程式为。同学们将制得的气体通入澄清石灰水,未变浑浊。猜想可能的原因是:
①澄清石灰水已变质;
②气体中除了有CO2外,还有氯化氢气体。
经过讨论设计如图2装置进行探究。试管I、试管Ⅱ盛放AgNO3溶液,试管Ⅲ中盛放原瓶中的澄清石灰水。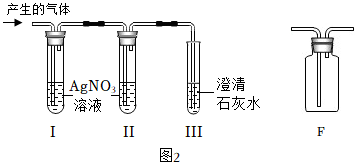
实验过程:
根据试管I中的现象,试管Ⅱ中硝酸银溶液未变浑浊,试管Ⅲ中的现象,同学们得出猜想①②两个原因均存在的结论。
问题讨论:
①试管Ⅱ中AgNO3溶液的作用为。
②同学们用F装置除去CO2中的氯化氢气体,F装置中的药品可选用(填序号)。
A.NaOH溶液
B.AgNO3溶液
C.饱和NaHCO3溶液发布:2024/12/24 8:0:11组卷:83引用:3难度:0.6 -
2.实验小组研究几种常用胃药的抗酸效果。
【查阅资料】
i.溶液的pH越大,酸性越弱。人体胃液的主要成分为盐酸,正常pH范围为0.9~1.5。
ⅱ.三种胃药的有效成分如下。胃药使用不当,可能导致胃胀气等症状。
【进行实验】胃药a 胃药b 胃药c 碳酸氢钠
NaHCO3铝碳酸镁
Al2Mg6(OH)16CO3•4H2O氢氧化铝
Al(OH)3
实验一:验证胃药是否能抗酸
各取25mLpH=1.20的稀盐酸放入三个小烧杯中,分别加入有效成分质量相同的三种胃药,搅拌120s,观察实验现象并用pH传感器测定反应后溶液的pH。
(1)胃药a和胃药b产生的气体均为CO2,实验室检验该气体的试剂是现象 反应后溶液的pH 胃药a 产生大量气体 6.37 胃药b 产生极少量气体 4.25 胃药c 无气体 1.34 。
(2)胃药c中的氢氧化铝与盐酸发生中和反应,其化学方程式为。
(3)由实验一可知三种胃药都能抗酸,依据是。
实验二:探究影响胃药抗酸效果的因素
下表所示实验中,均取25mLpH=1.20的稀盐酸,加入胃药,搅拌,用pH传感器测定一定反应时间后溶液的pH(反应后pH越大,抗酸效果越好)。
(4)探究反应时间对胃药抗酸效果的影响的实验组合是实验编号 胃药种类 有效成分质量/g 反应时间/s 溶液的pH ① 胃药a 0.5 60 6.02 ② 胃药a 0.5 120 6.37 ③ 胃药a 0.5 180 6.54 ④ 胃药b 0.5 60 3.93 ⑤ 胃药b 0.5 120 4.25 ⑥ 胃药b 0.5 180 4.70 ⑦ 胃药c 0.5 60 1.26 ⑧ 胃药c 0.5 120 1.34 ⑨ 胃药c 0.5 180 1.42 (填序号,任写一个组合)。
(5)由实验二可知,胃药种类对抗酸效果的影响的结论是。
【反思与评价】
(6)实际应用中,胃药b比胃药a、c使用得更多。结合上述实验,说明胃药b具有的优势是。发布:2024/12/25 13:0:1组卷:179引用:2难度:0.5 -
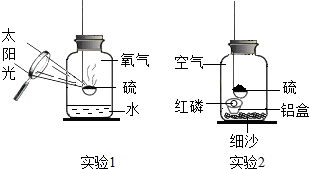 3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
【猜想】
甲同学猜想:硫燃烧耗尽了瓶内的氧气,所以它熄灭了;
乙同学猜想:硫燃烧后瓶内的二氧化硫(不支持硫的燃烧)浓度过高导致硫熄灭了;
丙同学猜想:甲和乙都只看到了问题的一个方面,他认为甲和乙都有道理;
丁同学猜想:.
【设计实验】丁同学设计了实验2进行实验验证自己的猜想:
【实验反思】(1)硫燃烧的化学方程式为实验步骤 实验现象 实验分析 实验结论 (1)把少量红磷放在铝制小盒内,然后放入装有细沙的集气瓶,塞紧瓶塞,用放大镜点燃硫,观察现象. 硫燃烧一会儿就熄灭了. 磷燃烧需满足的条件:①温度达到着火点;
②丁同学的猜想正确. (2)待冷却后,用放大镜聚光加热铝盒内的红磷,观察现象. 红磷燃烧,放出热量的同时产生了 ;实验2中硫燃烧的火焰颜色是色.
(2)实验1与课本实验相比,实验1的优点是;
(3)实验2中细沙的作用是.
(4)实验室中测定空气中氧气体积分数实验不用硫代替红磷的原因是.发布:2024/12/2 8:0:1组卷:31引用:1难度:0.5


