下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |


(2)④、⑤、⑧三种元素中,离子半径由大到小的顺序为
S2->O2->Na+
S2->O2->Na+
(填离子符号)。(3)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
H2SO4>H2CO3>H2SiO3
H2SO4>H2CO3>H2SiO3
(填化学式)。⑧和⑨元素的气态氢化物稳定性顺序为HCl>H2S
HCl>H2S
(填化学式)。(4)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
。(5)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式
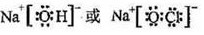
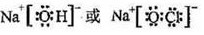
(6)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
,②的最高价氧化物的电子式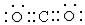
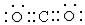
(7)能说明⑧的非金属性比⑨的非金属性
弱
弱
(填“强”或“弱”)的事实是Cl2+S2-=S+2Cl-
Cl2+S2-=S+2Cl-
(用离子方程式说明)。【考点】元素周期律和元素周期表的综合应用.
【答案】 ;S2->O2->Na+;H2SO4>H2CO3>H2SiO3;HCl>H2S;2Al+2OH-+2H2O=2AlO2-+3H2↑;
;S2->O2->Na+;H2SO4>H2CO3>H2SiO3;HCl>H2S;2Al+2OH-+2H2O=2AlO2-+3H2↑;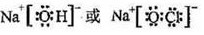 ;2Na2O2+2CO2=2Na2CO3+O2;
;2Na2O2+2CO2=2Na2CO3+O2;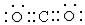 ;弱;Cl2+S2-=S+2Cl-
;弱;Cl2+S2-=S+2Cl-
 ;S2->O2->Na+;H2SO4>H2CO3>H2SiO3;HCl>H2S;2Al+2OH-+2H2O=2AlO2-+3H2↑;
;S2->O2->Na+;H2SO4>H2CO3>H2SiO3;HCl>H2S;2Al+2OH-+2H2O=2AlO2-+3H2↑;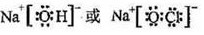 ;2Na2O2+2CO2=2Na2CO3+O2;
;2Na2O2+2CO2=2Na2CO3+O2;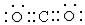 ;弱;Cl2+S2-=S+2Cl-
;弱;Cl2+S2-=S+2Cl-【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/8 8:0:9组卷:22引用:2难度:0.7
相似题
-
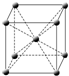 1.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
1.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
(1)元素a和元素b的简单氢化物熔点较高的是a b c d e f (用化学式填空),其原因是.
(2)a和d可形成不同晶体,下列说法正确的是(NA是阿伏加德罗常数).
A.元素a的单质可能是原子晶体或分子晶体
B.mg d元素形成的晶体中,含共价键数目为m NA/7
C.元素a与元素d形成的化合物40g,含NA个分子
D.元素d的最高价氧化物6g,含共价键物质的量为0.4mol
(3)c和e形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子有个,一个晶胞中的阴离子数目为个.晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,则晶体密度为g/cm3.
(4)f原子的外围电子排布式为,其晶胞结构如图,f单质的晶体密度为ρg/cm3,f相对原子质量为M,阿伏加德罗常数NA,则f的原子半径为.发布:2025/1/18 8:0:1组卷:8引用:1难度:0.3 -
2.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
 发布:2024/12/30 18:30:1组卷:8引用:3难度:0.7
发布:2024/12/30 18:30:1组卷:8引用:3难度:0.7 -
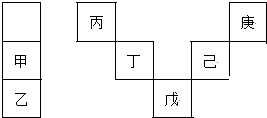
3.甲~庚等元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 发布:2024/12/30 19:30:2组卷:50引用:5难度:0.7
发布:2024/12/30 19:30:2组卷:50引用:5难度:0.7


