H2O2是一种常见试剂,在实验室、工业生产上有广泛用途
Ⅰ.H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
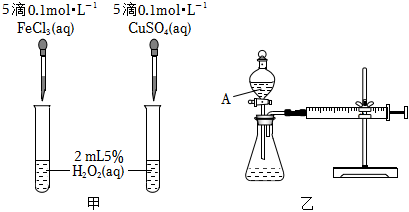
(1)若利用图甲装置,可通过观察 两个试管内产生气泡的快慢不同,其他相同两个试管内产生气泡的快慢不同,其他相同现象,从而定性比较得出结论。
(2)有同学提出将0.1mol⋅L-1FeCl3改为 0.050.05mol⋅L-1Fe2(SO4)3更为合理,其理由是 可以消除阴离子不同对实验的干扰可以消除阴离子不同对实验的干扰。
(3)若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是 产生40mL气体所需要的时间产生40mL气体所需要的时间。
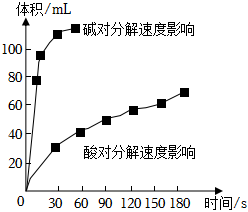
(4)如图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为 BaO2+H2SO4=H2O2+BaSO4↓BaO2+H2SO4=H2O2+BaSO4↓,支持这一方案的理由是 制备H2O2的环境为酸性环境,H2O2分解速率较慢制备H2O2的环境为酸性环境,H2O2分解速率较慢。
Ⅱ.实验室用H2O2快速制氧气,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲、乙、丙、丁四图所示:
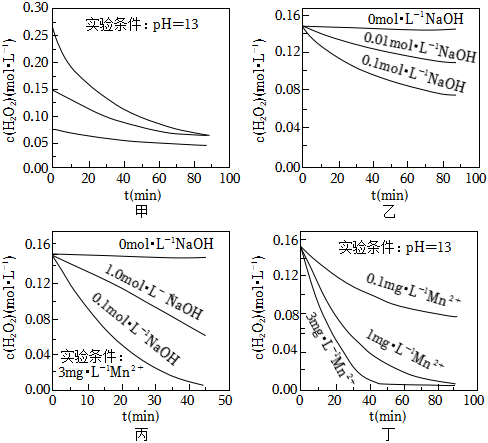
(5)下列说法正确的是:ADAD(填字母序号)。
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解越快
D.图丁表明,碱性溶液中,Mn2+浓度越大,对H2O2分解速率的影响越大
(6)催化剂Mn2+在反应中,改变了 ADEFADEF(填字母序号)。
A.反应速率
B.反应限度
C.反应焓变
D.反应路径
E.反应活化能
F.活化分子百分数
【考点】探究影响化学反应速率的因素.
【答案】两个试管内产生气泡的快慢不同,其他相同;0.05;可以消除阴离子不同对实验的干扰;产生40mL气体所需要的时间;BaO2+H2SO4=H2O2+BaSO4↓;制备H2O2的环境为酸性环境,H2O2分解速率较慢;AD;ADEF
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/20 8:0:8组卷:92引用:1难度:0.5
相似题
-
 1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6
1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6 -
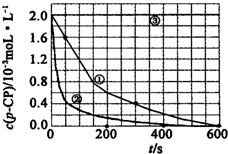 2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是实验序号 实验目的 T/K pH c/10-3mol•L-1 H2O2 Fe2+ ① 为以下实验作参照物 298 3 6.0 0.30 ② 探究温度对降解反应速率的影响 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=.
(3)实验①②表明,温度与该降解反应速率的关系是.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为c(I-)/(mol•L-1) c(Fe3+)/(mol•L-1) v/(mol•L-1•s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为.发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
3.为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题(已知:Cu2+、Fe3+对H2O2的分解起催化作用)。
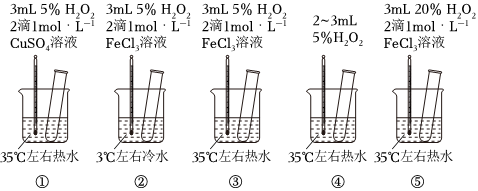
(1)为探究温度对化学反应速率的影响,应选择实验(填序号,下同),选择的依据是。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
(3)通过观察发现实验⑤比实验③现象明显,其原因是。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为。发布:2024/12/30 14:30:1组卷:8引用:5难度:0.5


