当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
|
原创
 更新中
更新中
|
知识梳理
总结方法
剖析考点
配加典例
浏览次数:2331
更新:2025年04月27日
|
 已完结
已完结
|
真题汇编
专项突破
夯实基础
稳步提升
浏览次数:82
更新:2025年04月27日
|
2721.新型锂电池含有一种物质是LiFePO4,LiFePO4中Li的化合价是+1价,P的化合价是+5价,则LiFePO4中Fe的化合价是( )
发布:2024/12/12 8:0:1组卷:8引用:1难度:0.72722.汤姆森发现电子,卢瑟福积极探索原子内部结构,门捷列夫列出了第一张元素周期表,徐寿为大量化学元素创造汉语名称……许许多多科学家为理论化学研究做出了巨大贡献,推开了物质的微观世界之门。下列有关说法错误的是( )
发布:2024/12/12 8:0:1组卷:21引用:1难度:0.62723.下列有关科学家在化学上贡献的叙述,错误的是( )
发布:2024/12/12 8:0:1组卷:18引用:1难度:0.92724.下列有关“化学之最”的叙述中,正确的是
A.日常生活中最常用的溶剂是水 B.熔点最高的金属为汞C.门捷列夫最早发现电子 D.发布:2024/12/12 8:0:1组卷:11引用:1难度:0.82725.人们为揭示原子结构的奥秘,经历了漫长的探究过程.1897年汤姆生发现电子并提出类似“西瓜”的原子模型;
1911年卢瑟福等人为探索原子的内部结构又进行了下面的实验:用一束带正电的、质量比电子大得多的高速运
动的a粒子轰击金箔,发现:①大多数a粒子能穿透金箔而不改变原来的运动方向;②一小部分a粒子改变了原来的运动方向;③有极少数a粒子被弹了回来.③少部分α粒子改变原来的方向.
请你根据对原子结构的认识,分析出现上述现象的原因:
现象①:;
现象②:;
现象③:.
(2)元素周期表是学习化学的重要工具.如图2是1~18号元素原子核外电子排布,我们对它进行研究: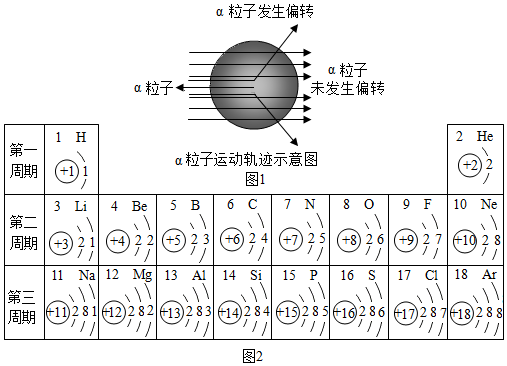
①第16号元素属于元素(填“金属”或“非金属”),它在化学反应中容易(填“得”或“失”)电子;
②元素的化学性质与原子结构中的数关系密切;
③在同一族中,各元素的原子结构呈现的规律有(任写一点);
④核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是.
(3)已知碳12原子的质量为a kg,则相对原子质量为b的某原子的实际质量为.发布:2024/12/12 8:0:1组卷:24引用:1难度:0.32726.化肥为保持粮食丰产起到了重要作用.常用化肥有:①尿素[CO(NH2)2]、②氯化钾(KCl)、③硝酸铵(NH4NO3)、④磷矿粉[Ca3(PO4)2].
(1)以上化肥中属于钾肥的是(填序号).
(2)Ca3(PO4)2中P的化合价为.
(3)尿素因含有元素,所以是一种氮肥.尿素分子中所含C、O、N、H的原子个数比为.发布:2024/12/12 8:0:1组卷:176引用:1难度:0.52727.下列有关微粒的说法正确的是( )
发布:2024/12/12 8:0:1组卷:4引用:1难度:0.92728.实验室有四个药品橱,已存放如下药品:
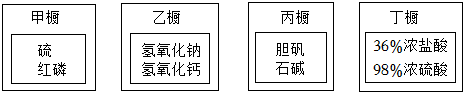
(1)实验室新购进一些木炭,应将它存放在橱中(填“甲”、“乙”、“丙”或“丁”)。
(2)乙橱中的固体物质可以作干燥剂的是(写化学式)。
(3)丙橱中药品都属于类别(填“酸”、“碱”,“盐”或“单质”)。其中石碱的化学式为Na2CO3•10H2O,石碱由种元素组成,摩尔质量为,0.1mol的石碱中约含氢原子个。(用科学记数法表示)
(4)丁橱的物质露置于空气一段时间后(不考虑水分挥发),说法正确的是。
Ⅰ.溶质质量都减少
Ⅱ.溶剂质量都增大
Ⅲ.溶质质量分数都减少
Ⅳ.溶液质量都减少发布:2024/12/12 8:0:1组卷:9引用:2难度:0.7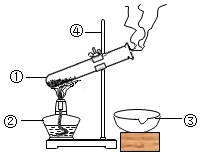 2729.如图是硫酸铜晶体加热的装置
2729.如图是硫酸铜晶体加热的装置
(1)有标号的仪器名称是
①;②;
③;④;
(2)图中的错误是.
(3)经改正后,这个实验的现象是.发布:2024/12/12 8:0:1组卷:3引用:1难度:0.32730.硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程

(1)反应①的化学方程式为.
(2)途径I中,反应②、③的化学方程式分别为②,③;途径Ⅱ中,反应④的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O.从环保和经济的角度分析,利用途径△(选填“I”或“Ⅱ”)制取硫酸铜的方案更合理.
(3)某化学兴趣小组同学用足量铜与10g质量分数为98%的浓硫酸在加热条件下充分反应,生成SO2的质量应(选填字母).
A.等于3.2g B.小于3.2g C.大于3.2g
(4)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应.现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)═ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是,理由是.发布:2024/12/12 8:0:1组卷:59引用:5难度:0.3



