当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
专题复习
温故知新
人教版(2019)
苏教版(2019)
浏览次数:17
更新:2025年06月26日
|
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2290
更新:2025年06月03日
|
1421.图是从NaCl成CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
 发布:2024/12/30 11:30:1组卷:115引用:7难度:0.5
发布:2024/12/30 11:30:1组卷:115引用:7难度:0.51422.(NH4)2S2O8电化学循环氧化法可用于废水中苯酚的降解,示意图如图。
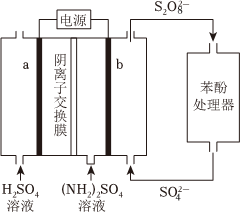
(1)(NH4)2S2O8的电解法制备。
已知:电解效率η的定义为η(B)=×100%。n(生成B所用的电子)n(通过电极的电子)
①电极b是极。
②生成S2的电极反应式是O2-8。
③向阳极室和阴极室各加入100mL溶液。制备S2的同时,还在电极b表面收集到2.5×10-4mol气体,气体是O2-8。经测定η(S2)为80%,不考虑其他副反应,则制备的(NH4)2S2O8的物质的量浓度为O2-8mol/L。
(2)苯酚的降解
已知:•具有强氧化性,Fe2+性度较高时会导致SO-4•猝灭。S2SO-4可将苯酚氧化为CO2,但反应速率较慢。加入Fe2+可加快反应,过程为:O2-8
i.S2+Fe2+═O2-8+SO2-4•+Fe3+SO-4
ii.•将苯酚氧化SO-4
①•氧化苯酚的离子方程式是SO-4。
②将电解得到的含S2溶液稀释后加入苯酚处理器,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图。O2-8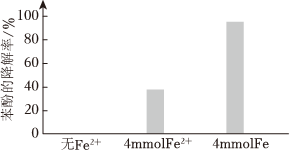
用等物质的量的铁粉代替FeSO4,可明显提高苯酚的降解率,主要原因是。
(3)苯酚残留量的测定
已知:电解中转移1mol电子所消耗的电量为F库仑。
取处理后的水样100mL,酸化后加入KBr溶液,通电。电解产生的Br2全部与苯酚反应,当苯酚完全反应时,消耗的电量为a库仑,则样品中苯酚的含量为g/L。(苯酚的摩尔质量:94g/mol)发布:2024/12/30 11:30:1组卷:166引用:3难度:0.41423.现有几组物质的熔点(℃)数据:
据此回答下列问题:A组 B组 C组 D组 金刚石:>3 550 Li:181 HF:-84 NaCl:801 硅晶体:1 410 Na:98 HCl:-114 KCl:770 硼晶体:2 300 K:63 HBr:-87 RbCl:715 二氧化硅:1 710 Rb:39 HI:-51 CsCl:645
(1)A组属于晶体,其熔化时克服的微粒间的作用力是.
(2)B组晶体共同的物理性质是(填序号).
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于.
(4)D组晶体可能具有的性质是(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:.发布:2024/12/30 11:30:1组卷:88引用:8难度:0.71424.下列关于杂化轨道的叙述中,不正确的是( )
发布:2024/12/30 11:30:1组卷:78引用:9难度:0.71425.某元素+2价离子的电子排布式为[Kr]4d2,该元素在元素周期表中位于( )
发布:2024/12/30 11:30:1组卷:80引用:3难度:0.51426.白醋是烹调中的酸味辅料,能改善调节人体的新陈代谢,其主要成分CH3COOH为一元弱酸。25℃时,下列有关说法正确的是( )
发布:2024/12/30 11:30:1组卷:301引用:5难度:0.61427.开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为;LiBH4中Li、B、H 元素的电负性由大到小的排列顺序为。
②另有一种含钛元素的新型材料,其理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型为。
(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为。
②B、C、N 与O元素的第一电离能由大到小的顺序为。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作(选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
①该金属元素是I1/kJ•mol-1 I2/kJ•mol-1 I3/kJ•mol-1 I4/kJ•mol-1 I5/kJ•mol-1 738 1451 7733 10540 13630 (填元素符号)。
②若氢化物的晶胞结构如图2所示(有4 个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg•cm-3,则该晶胞的体积为cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。发布:2024/12/30 11:30:1组卷:133引用:5难度:0.11428.根据下表给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是( )
NaCl MgCl2 AlCl3 SiCl4 单质B 熔点/℃ 810 710 180 68 2300 沸点/℃ 1465 1418 160 57 2500 发布:2024/12/30 11:30:1组卷:62引用:4难度:0.51429.原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.则T元素的基态原子外围电子(价电子)排布式为
;Q3+离子的核外未成对电子数是.发布:2024/12/30 11:30:1组卷:102引用:4难度:0.51430.CH4、NH3、H2O和HF均为含10e-的分子.
(1)N、O、F三种元素中,与基态C原子的核外未成对电子数相等的元素是(写元素名称),其基态原子的价层电子排布图为.
(2)C、N、O、F四种元素第一电离能由大到小的顺序是(用元素符号表示).
(3)CH4、NH3和H2O分子中,从原子轨道的重叠方向来说,三种分子均含共价键类型为,三种分子的中心原子的杂化轨道类型均为.
(4)CH4燃烧生成CO、CO2和H2O.
①在CO气流中轻微加热金属镍(Ni),生成无色挥发性液态Ni(CO)4,试推测四羰基镍的晶体类型为.
②OCN-与CO2互为等电子体,则OCN-结构式为.
(5)与碳同族的硅形成的硅酸盐结构中的基本结构单元为[SiO4]四面体,由两个结构单元通过共用一个原子形成的硅酸盐阴离子的化学式为.发布:2024/12/30 11:30:1组卷:82引用:3难度:0.1



